临床试验的设计,必须确保进入临床的每一剂细胞制品都能达到最佳效果。有时候并不是干细胞治疗无效,有可能是给药方式的选择出现了问题。本期,我们将针对间充质干细胞的给药方式展开论述。
-01-
间充质干细胞的给药方式
正如活细胞的效力需要体外评估一样,间充质干细胞的给药方式同样也会影响其进入体内后的行为(包括药代动力学和生物学特性)。
具体来讲,注射点部位、注射器、载体材料和缓冲液等因素都会影响细胞的给药效果。不同的注射部位可能导致细胞注射液回流的变化,注射器(针头的大小/形状)可能导致细胞注射液剪切速率和剪切应力的变化,而这些变化都会影响射细胞的活力。
干细胞目前常见的给药方式是循环系统给药(静脉注射,动脉注射),局部注射。局部给药比较复杂,包括鞘内注射(常见于神经系统病变),局部注射(关节腔内注射,椎间盘,心肌注射,肌内注射,气管注射);结合生物材料或基质(烧伤烫伤,膝关节炎,子宫内膜损伤,椎间盘等等)。
在干细胞临床中,无论是局部给药,还是循环系统给药,都面临着各种临床挑战。
局部给药方式
局部给药方式,在细胞药物临床试验使用较为广泛。已注册的间充质干细胞临床试验中有49%采取局部给药。大多数已进入Phase III期临床试验的间充质干细胞疗法均已在各种临床适应症(包括慢性腰痛,肛周瘘管和慢性心力衰竭)中使用了局部给药(即鞘内,病灶内和心内膜)。
局部给药方式,可控性强,细胞可以快速定位在病灶,相对效果更好。不同的适应症,相同适应症中不同的病程,不同的治疗诉求,需要不同的给药方式。例如,在治疗缺血性卒中慢性期阶段的方案中,局部给药比全身给药更有效。然而,移植后的细胞在给药部位的保留时间和存活率不足是一个挑战,这影响治疗效果。
局部给药后,诸多因素影响着细胞的存活,无论是存活时间还是数量。其中,尤为重要的是病灶部位形成的恶劣微环境,影响着局部给药后细胞的存活质量。研究表明,移植后数小时内,仅不到 5%的移植细胞仍在注射部位。一项使用放射线标记的间充质干细胞治疗冠心病的研究发现,间充质干细胞在注射1小时后只有2.1%仍在注射部位,其他大部分出现在肝脏和脾脏。
免疫介导的损伤和细胞凋亡,也会影响局部给药后细胞的存活。一项大鼠实验显示,间充质干细胞局部给药2天后,心肌梗塞部位就已无法检测到存活的间充质干细胞。因为营养输送和氧气的有限扩散,也会影响局部给药后细胞的存活。在距离血管约200μm范围内,细胞才能获取足够的营养和氧气。这也限制了间充质干细胞在受损部位的治疗作用,因为新的血管生成需要时间。
因此,针对某些疾病,如果要想提高疗效,尽量会将干细胞“送到”损伤位置进行修复。比如局部注射,腰穿,介入等方法,会提高其归巢性和发挥更好的里临床效果。(具体给药的方式选择,取决于很多因素,最主要的是适应症)
循环系统给药方式
局部给药并不适合所有的适应症,因为局部给药可能造成新的创伤或严重并发症。这时候,临床治疗会考虑选择循环系统给药。循环系统给药分为静脉给药和动脉给药。静脉输注由于操作简便、侵袭性小、可重复性强,所以临床治疗中较为常见。但比起局部给药,使用循环系统给药的间充质干细胞,由于靶点距离较远,归巢性往往不足,从而影响治疗效果。
采用循环系统给药方输注间充质干细胞,有两个主要挑战:立即经血液介导的炎症反应(IBMIR)及细胞留存时间不足。
▉ 血液介导的炎症反应
至少在一定程度上, 大量细胞输注产生的微血栓、即时血液介导的炎症反应(instantblood-mediated inflammatory reaction,IBMIR)等不良反应的出现与输注间充质干细胞的特性、数量以及病人的个体情况有关。间充质干细胞表面上的促凝剂(如组织因子
另外,组织来源不同、供体来源不同和倍增次数不同的间充质干细胞产品,对组织因子(TF)的表达和IBMIR严重程度有很大影响。除引发凝血外,间充质干细胞与人血清接触后的IBMIR已被证明可以激活所有三种经典途径,替代途径和凝集素途径的补体。因此,采用循环系统给药,间充质干细胞治疗的临床安全性取决于IBMIR的最佳控制。
▉ 驻留和归巢时间不足
采用循环系统给药时,关键因素是保持足够长的时间,需要克服从输注点到病灶路上的“九九八十一难”,方能将间充质干细胞递送到受损组织。然而,众所周知的是,通过静脉输注的间充质干细胞大部分都会快速集中(24小时内)到肺毛细血管,而后被单核-巨噬细胞吞噬,造成间充质干细胞的体内循环及归巢时间严重不足,同样影响着临床疗效。
经循环系统给药的间充质干细胞常常无法到达目标组织,从而使其不足以将治疗细胞输送到患病部位。
-02-
如何提高给药方式的效率
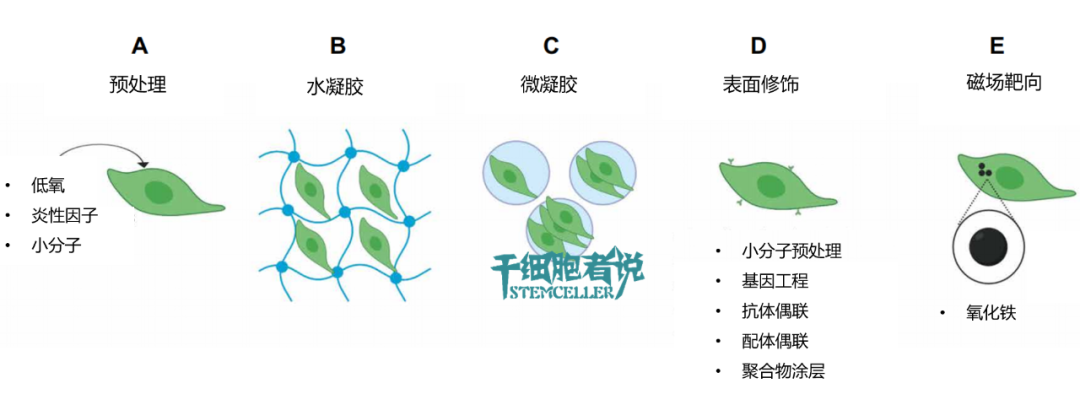
图1. 如何提高间充质干细胞给药方式的效率
A) 通过低氧、炎性因子、小分子等预处理,可提高MSCs存活率。但不适用刚解冻后的细胞。
B) 通过水凝胶包裹,可使MSCs在局部给药后存活数周。但不适用全身给药,仅适合局部给药。
C) 通过微凝胶包裹MSCs,可提高其存活率。微凝胶既适用于局部注射,也适用于全身注射。但微凝胶的物理屏障可能影响MSCs的归巢能力。
D) 通过基因工程/抗体偶联/聚合物涂层在MSCs表面进行修饰,可实现MSCs的靶向能力。
E) 通过负载氧化铁,MSCs可在外部磁场引导下到达靶点。也可通过磁共振成像监测MSCs在体内的生物分布,但不适用刚解冻后的细胞。
局部给药
改善局部给药效果,目前已经有诸多策略。
▉ 体外预处理
体外预处理是一种简单的策略。通常,病灶部位处于一个缺氧的微环境,而低氧预处理可上调某些生长因子的表达,帮助间充质干细胞尽快适应低氧微环境。在心肌梗死大鼠模型中,经低氧预处理的间充质干细胞被注射到心肌后,3天内死亡的细胞数比未处理的少40%,而且改善了梗死心肌的血管形成,提高了治疗效果。但是,这种预处理方式,只适合新鲜的细胞,不适用刚解冻后的细胞,因为存活因子的表达高度依赖于环境。
▉ 生物材料封装
生物材料封装是另一种潜在策略。在大鼠心肌梗死模型中,单纯间充质干细胞在体内存活不到2天,而经处理水凝胶包裹的间充质干细胞存活时间长达16天。而且,后者能显著减少疤痕形成,加速血管生成,增加心室壁厚度。
循环系统给药
为了减轻IBMIR,一个策略是提倡在临床上使用低剂量抗凝剂(如肝素)。另一个策略是开发新的间充质干细胞培养基,因为AB血浆(ABP)中的ABO抗原、补体和凝血因子会加重IBMIR。其他替代方法还有:在细胞表面覆盖肝素分子涂层,通过基因编辑技术降低TF表达,或者让间充质干细胞表达血液调节分子。
▉ 延长体内留存时间
微囊化是将间充质干细胞封装在直径30-50μm的微粒水凝胶内,既不干扰间充质干细胞的旁分泌作用,又可显著增加其在体内的留存时间。有趣的是,微凝胶内的细胞数量可能是控制间充质干细胞留存时间的重要因素。
微凝胶
研究表明,多细胞微凝胶的半衰期大于50小时,单细胞微凝胶半衰期约20小时,未经修饰的间充质干细胞半衰期则小于2小时。单细胞微凝胶的优势是能减少纤维化囊形成,增加表面积体积比,有利于间充质干细胞发挥旁分泌作用。而多细胞微凝胶的优势是胶原蛋白I水平更高,氧张力更低,更能延长间充质干细胞留存时间。
▉ 改善归巢能力
上调间充质干细胞配体的生物工程技术,可强化间充质干细胞与炎症部位内皮细胞或趋化因子之间的相互作用,从而改善间充质干细胞归巢。例如在大鼠脑缺血模型中发现,用丙戊酸和锂可以诱导间充质干细胞的CXCR4和MMP-9上调,增加间充质干细胞归巢,改善功能恢复并缩小脑梗塞体积。
▉ 磁场靶向
通过磁靶向技术可将经磁性标记的间充质干细胞引导到靶组织,大大提高间充质干细胞归巢的数量。氧化铁标记的间充质干细胞在大鼠模型中静脉输注后,显示出在视网膜归巢率增加了10倍,与非磁性间充质干细胞相比,注射后1周,磁性间充质干细胞更好地穿透了内部和外部视网膜。
磁靶向
整体而言,改善细胞留存时间和归巢能力的给药方式,目前大多处于临床前研究阶段,少部分进入临床试验阶段。这些策略可以解决间充质干细胞细胞留存时间和归巢到病灶部位的挑战,有助于改善各种疾病的临床结果。
-03-
文末小结
本期内容,我们简单介绍了间充质干细胞治疗的给药方式。目前常见的给药方式是循环系统给药和局部注射。循环系统给药方式,细胞常常无法到达目标组织,从而使其不足以将治疗细胞输送到患病部位。局部给药方式,细胞可以快速定位在病灶,相对效果更好,但缺点是容易造成新的创伤或并发症。不同的适应症,选择合适的给药方式尤为重要。
如果细胞产品的效力得到了保证,给药方的选择式也合适,那么是否就能一定保证间充质干细胞的临床效果呢?显然不行!事实上,患者的选择也是一个重要的考虑因素。患者的细胞毒性反应、炎症状态和病灶微环境的变化,是用药后间充质干细胞临床疗效的重要因素。
复制本文链接 文章为作者独立观点不代表本网站立场,未经允许不得转载。

 京公网安备
11010802036058号
京公网安备
11010802036058号
评论