免疫衰老是一种不可避免的现象,它涉及免疫系统随着年龄的增长而发生的重塑。65岁以上的个体感染、癌症发病率更高、疾病死亡率增加,并且疫苗效力降低。目前,尚无有效的治疗措施可用于改善免疫衰老。
日前,发表在《International journal of molecular sciences》上的一篇综述[1], 总结了间充质干细胞疗法对抗免疫衰老的潜力。间充质干细胞疗法是一种有希望的方式来恢复老化的免疫系统,间充质干细胞可以安全地减少炎症标志物,恢复 T 细胞库,改善炎症性疾病的组织病理学。

随着年龄的增长,间充质干细胞 (MSCs) 的衰老被认为是免疫力下降的原因之一。因此,研究认为,间充质干细胞的离体扩增和优化注射剂量对于维持和增强间充质干细胞在体内的作用是必要的。
01
全球老龄化加速,免疫衰老受关注
据联合国推测,2019年至2050年,65岁及以上的人口数量将翻一番。当下,全球人口老龄化正在加速,与年龄相关的疾病也变得越来越普遍。其中,衰老也包括了免疫系统的退化,称为免疫衰老。

由于免疫力退化,老年人群更容易受到严重的感染,与年轻患者相比,65-74岁的老年人感染社区获得性肺炎的风险增加了21%,菌血症和败血症在老年人中也更为普遍。其次,作为衰老的直接结果,免疫系统处于持续的亚临床炎症状态,这种状态可进一步加剧多种疾病,包括心血管疾病(心肌梗塞、高血压、动脉粥样硬化)、认知障碍(阿尔茨海默病、帕金森病)、类风湿关节炎和代谢疾病(II型糖尿病)等。
02
间充质干细胞对免疫系统的作用机制
目前,有一些措施可以延缓衰弱的发作并改善与年龄相关的疾病的发病率,但仍没有针对免疫衰老的明确治疗方案。
大量的体内和体外研究证明,间充质干细胞具有低免疫原性、优异的免疫调节功能、归巢能力,以及通过多能分化和旁分泌来再生受损组织。间充质干细胞是多能祖细胞,可从骨髓、脂肪组织、牙齿组织、皮肤和围产期组织(脐带和胎盘)中分离。间充质干细胞可以分化为脂肪细胞、成骨细胞和软骨细胞。
尽管间充质干细胞不分化为免疫细胞,但间充质干细胞为造血干细胞 (HSCs) 分化为骨髓和淋巴样细胞(本质上是免疫细胞)提供了支持性的微环境。这种特殊的环境通过控制造血干细胞的增殖和凋亡活动来维持造血干细胞的寿命,从而发挥重要的作用。
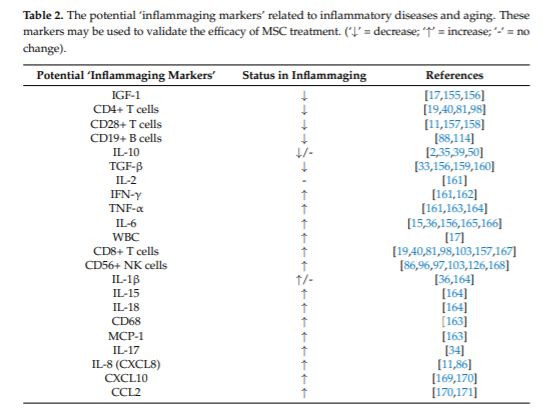
表1(来自文献[1]):显示了与炎症性疾病和衰老相关的潜在“炎症标志物”,这些标志物可用于验证间充质干细胞治疗的功效。
一些证据表明,间充质干细胞对免疫系统的改善作用不是通过直接植入和细胞替代,而是通过旁分泌方式和直接的细胞间接触[2-3]。间充质干细胞分泌可溶性旁分泌因子,其中IL-10是一种抗炎和免疫调节细胞因子,IL-6 和 IL-8与间充质干细胞组织修复潜力有关,TGF-β能够促进CD8+ T 细胞和Treg细胞的发育,同时抑制Th1。此外,间充质干细胞还表达FasL和PD-L1 以进行接触依赖性抑制以诱导 T 细胞凋亡。
03
未来临床发展的思考要点
关于间充质干细胞疗法在老化的免疫系统领域的临床应用,未来临床发展仍然需要考虑诸多因素。在未来的临床应用与转化上,干细胞疗法需要注射大量细胞,因此首先需要考虑的是临床副作用等风险因素。不过,有研究认为从间充质干细胞中提取的外泌体可以通过减少NK 细胞数量和TNF-α 转录来规避副反应,并仍然发挥免疫调节功能[3]。
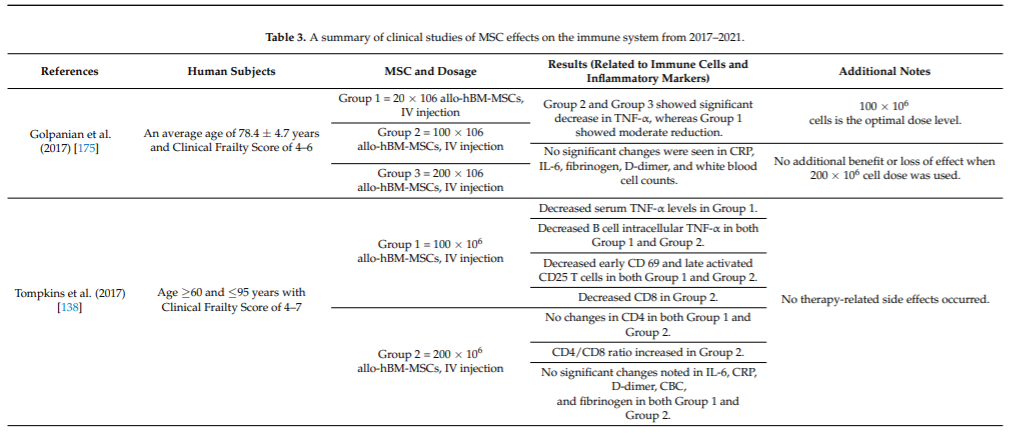
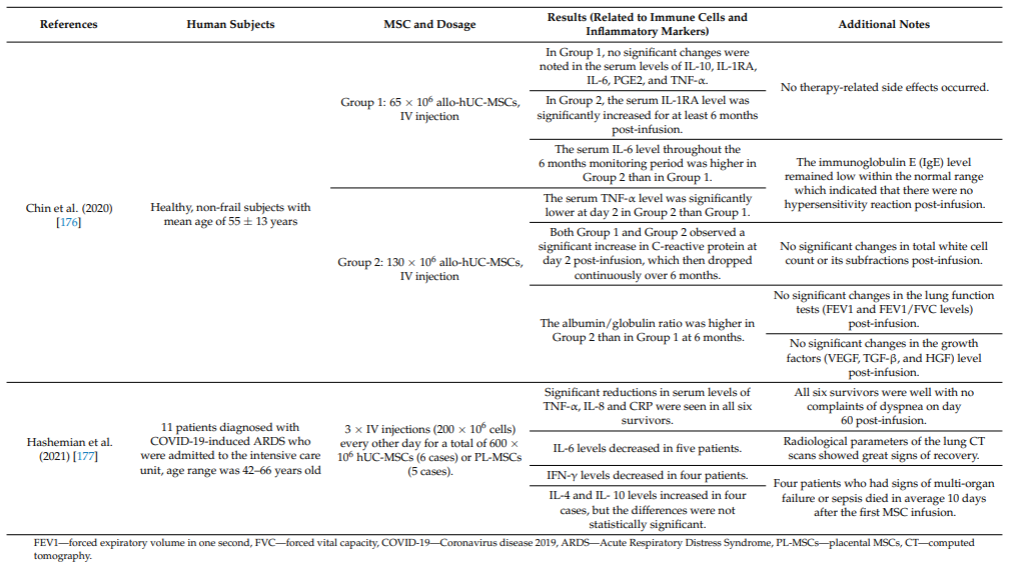
表2(来自文献[1]):2017-2021年间充质干细胞对免疫系统影响的临床研究总结。
此外,用于移植的间充质干细胞的最佳剂量仍然需要进一步探讨。尽管研究报告指出使用高达 12 亿个细胞的剂量是安全的,然而,较高的剂量并不表示较高的治疗效果,因为一些研究报告了较低剂量组得到了更好的临床结果。因此,未来对有效改善免疫系统衰老的间充质干细胞的最小有效剂量需要更多的研究。


表3(来自文献[1]):总结了在病理疾病模型中报告 MSC 移植对免疫系统影响的体内数据。
目前,有关间充质干细胞对免疫系统影响的数据主要来自动物研究。此外,在不同的动物模型和实验条件下观察到的结果也存在差异。因此未来仍然需要开展更多的研究来探讨间充质干细胞对免疫细胞的影响。随着临床研究结果的不断输出,相信未来间充质干细胞在逆转免疫系统老化领域将能发挥更大的临床作用。
参考文献:
[1] Yeo, G., Ng, M. H., Nordin, F. B., & Law, J. X. (2021). Potential of Mesenchymal Stem Cells in the Rejuvenation of the Aging Immune System. International journal of molecular sciences, 22(11), 5749. https://doi.org/10.3390/ijms22115749
[2] Mushahary, D., Spittler, A., Kasper, C., Weber, V., & Charwat, V. (2018). Isolation, cultivation, and characterization of human mesenchymal stem cells. Cytometry. Part A : the journal of the International Society for Analytical Cytology, 93(1), 19–31. https://doi.org/10.1002/cyto.a.23242
[3] Rojas, M., Xu, J., Woods, C. R., Mora, A. L., Spears, W., Roman, J., & Brigham, K. L. (2005). Bone marrow-derived mesenchymal stem cells in repair of the injured lung. American journal of respiratory cell and molecular biology, 33(2), 145–152. https://doi.org/10.1165/rcmb.2004-0330OC
[4] Koch, M., Lemke, A., & Lange, C. (2015). Extracellular Vesicles from MSC Modulate the Immune Response to Renal Allografts in a MHC Disparate Rat Model. Stem cells international, 2015, 486141.
复制本文链接 文章为作者独立观点不代表本网站立场,未经允许不得转载。

 京公网安备
11010802036058号
京公网安备
11010802036058号
评论