B细胞受体(BCR,B cell receptor)是B细胞细胞膜上的一类跨膜蛋白质,由膜结合免疫球蛋白(mIg)及信号转导组件共同组成。 通过生物化学的信号转导和从免疫突触中抓取抗原,B细胞受体控制着B细胞的活化。 B细胞可以通过调动生物化学模块来使受体聚集、细胞变形、产生拉力、转移受体,达到收集抓取抗原的目的,最终使抗原内吞并呈递抗原。B细胞的力学活性能够影响B细胞受体和抗原的动态结合,相关的正负调节机制能够改变B细胞上的抗原载量。 具体来说,聚集和铺展可以增强B细胞受体和抗原之间的相互作用,从而加强B细胞的敏感度和活性。 另一方面,拉力使得抗原趋于和B细胞受体解除连接,可以用于筛选抗原的亲和度质量。
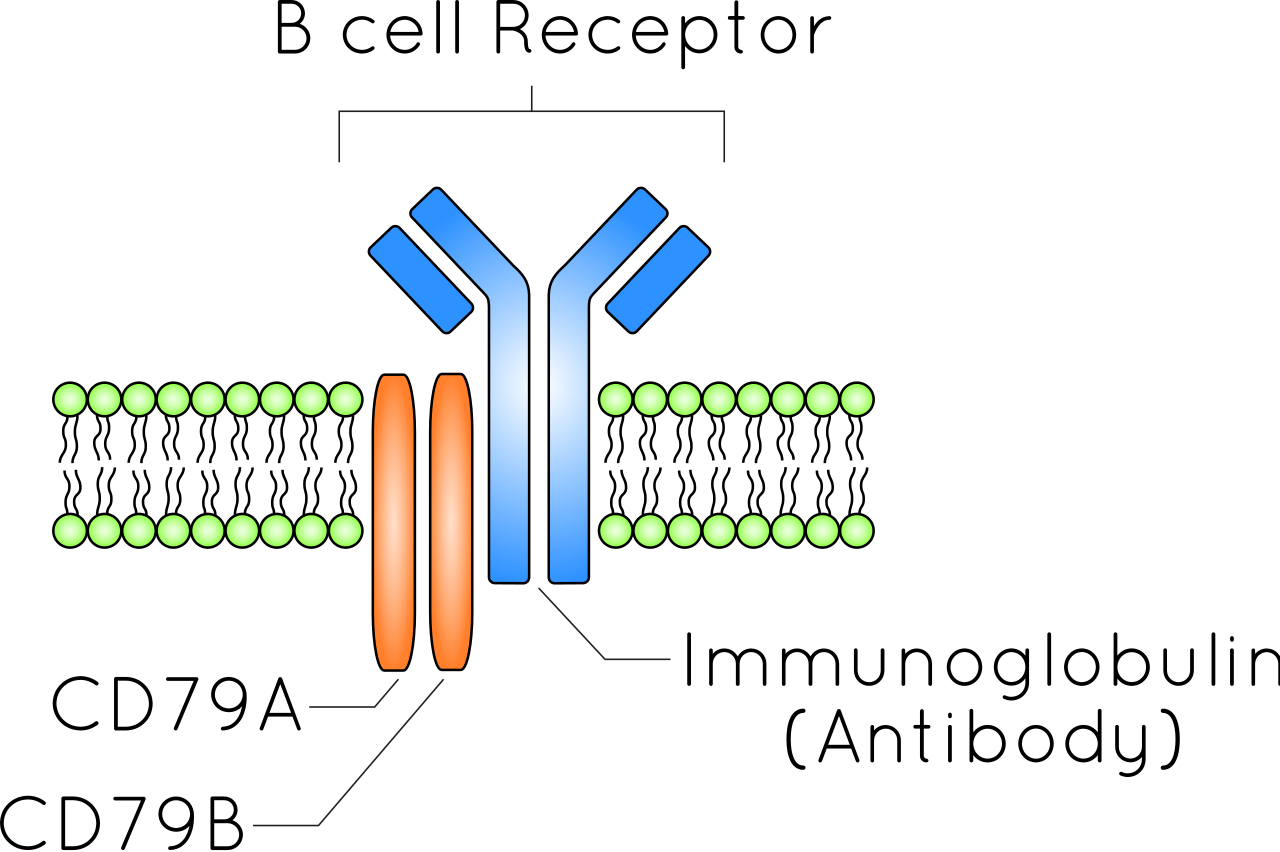
B细胞受体(BCR)是B细胞表面上的跨膜蛋白。B细胞受体由CD79和免疫球蛋白组成。图中B细胞的质膜由绿色磷脂指示。B细胞受体既延伸到细胞外(质膜上方),又延伸到细胞内(质膜下方)。
B细胞受体虽然结合在细胞膜上,但是就像其他的抗体分子一样,具有一个独特的、随机的抗原结合区。和其他抗体分子不同的地方在于,B细胞受体对于B细胞的活化、生存和发育有着至关重要的作用。B细胞第一次结合到可以和其B细胞受体结合的抗原(即同源抗原)后,就可以被活化,增殖并分化成可以分泌抗体的浆细胞以及寿命较长的记忆细胞。 B细胞受体和抗原的相互作用有两个重要功能,第一是启动下游的信号转导,涉及到自身的受体多聚化; 第二是介导抗原的内吞,后续处理和向辅助T细胞的抗原呈递。
B细胞受体的发育和结构
B细胞发育过程中的第一个检查点是生成功能性的B细胞受体前体(pre-BCR)。B细胞受体前体由两条代用免疫球蛋白轻链和两条重链组成,并没有和Ig-α和Ig-β分子相互连接。
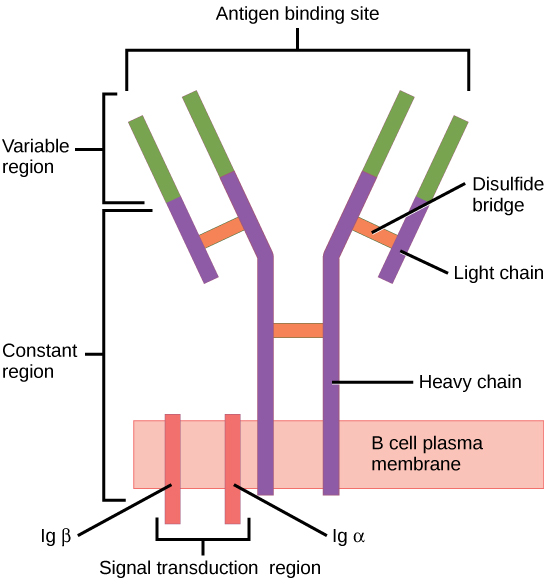
B细胞受体的一般结构。
包括了膜结合的免疫球蛋白分子和Ig-α/Ig-β信号转导组件。二硫键连接着免疫球蛋白分子和信号转导组件。
B细胞受体由两部分组成:
某一亚型(IgD、IgM、IgA、IgG或者IgE)的膜结合免疫球蛋白(mIg)。除了C端疏水的膜结合区和胞内区,这些膜结合免疫球蛋白和分泌型的免疫球蛋白单体是相同的,有两条重链(IgHs)和两条轻链(IgLs)。
信号转导组件:Ig-α/Ig-β的异二聚体(CD79),由二硫键连接。两个亚基都是跨膜蛋白,在胞内区都有免疫受体酪氨酸的活化基序(ITAM)。
B细胞受体的抗原结合区,和其分泌抗体的抗原结合区由同样的基因编码。从一小段基因序列随机产生大量不同的B细胞受体(抗体)序列的具体过程,称为V(D)J重组,是把原始序列中的分段重新随机排列组合,加上自发突变的过程。这一产生多样性的过程是必要的,因为机体可能遭遇到的抗原种类远多于基因组中基因的数量。免疫球蛋白重链基因的重排是B细胞发育初期的重要事件。重链JH (joining)和DH(diversity)区段的重组连接依赖于酶RAG2和RAG1。 随后VH区段也会连接上去,成为完整的重组重链基因。
B细胞受体一般通过非共价键与抗原表位结合。成熟的B细胞在没有合适抗原刺激的情况下,只能在外周循环中生存很短的一段时间,就会走向细胞凋亡。 这样是为了使B细胞在外周循环中执行免疫功能的效率达到最高。
B细胞受体的信号通路
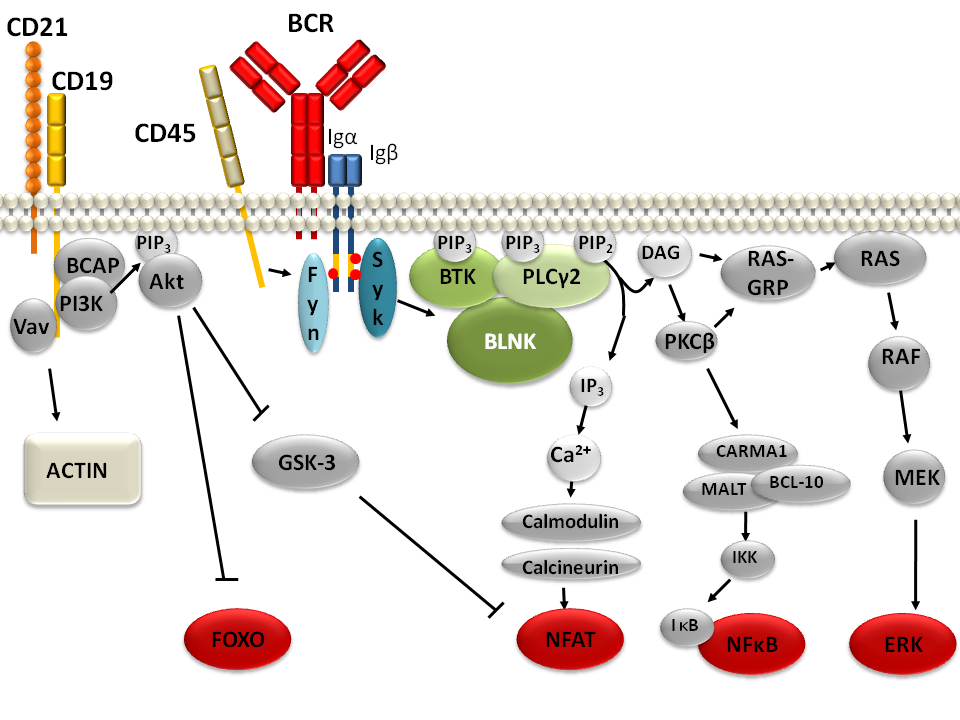
B细胞受体信号传导途径的示意图。
B细胞受体的聚集会迅速激活SRC家族激酶,包括BLK、LYN和FYN以及SYK和BTK酪氨酸激酶。最终会形成由B细胞受体、上述酪氨酸激酶和接头蛋白组成的“信号小体(signalosome)”。
B细胞受体作为B细胞活动的关键调节位点,参与了多个信号通路。一般而言,膜结合免疫球蛋白(mIg)负责结合胞外抗原,而Ig-α/Ig-β的异二聚体负责将信号传导到细胞内。B细胞受体的激活受到许多因素的调控,包括膜结合免疫球蛋白的结构差异、信号转导接头蛋白(例如GAB1、BLNK、GRB2、CARD11)、激酶的活性(LYN、SYK、PI3K)、磷酸酶的活性(SHIP-1、SHP-1、PTEN)、以及microRNA的水平。
IKK/NF-κB转录因子通路:Ig-α/Ig-β的异二聚体(CD79)以及其他一些蛋白质,会在B细胞受体结合抗原之后,去激活PLC-γ,然后结合成为c-SMAC。激活的PLC-γ可以把PIP2切割为IP3和DAG(甘油二酯)。IP3作为第二信使,会导致细胞内钙离子浓度的提升(通过释放内质网中储存的钙离子或者从细胞外导入钙离子),钙离子和DAG的协同最终会导致PKCβ的激活。接下来,PKCβ(直接或者间接地)磷酸化NF-κB信号转导复合体中的蛋白质CARMA1(这个复合体由CARMA1、BCL10和MALT1组成),通过与CARMA1/BCL10/MALT1复合体相关的几个泛素化酶招募IKK(IkB激酶)和TAK1。MALT1本身是一种类caspase蛋白质,能够切割另一种在NF-κB信号通路中起抑制作用的蛋白质,A20(A20会把NF-κB泛素化的底物去泛素化)。TAK1在被泛素化酶招募到信号转导复合体后,会磷酸化IKK三聚体。IKK接下来会磷酸化IkB(结合在NF-κB上的抑制蛋白质),使IkB降解,释放细胞质中的NF-κB。NF-κB从而可以转移到细胞核内,与特定的DNA元件结合,招募转录因子并启动下游基因的转录。
配体和B细胞受体的结合也会导致蛋白质BCAP的磷酸化。这样,具有能结合磷酸化酪氨酸的SH2结构域的一些蛋白质就会结合在BCAP上并被激活,例如PI3K。激活的PI3K能够磷酸化PIP2,生成PIP3。具有PH(Pleckstrin homology)结构域的蛋白质可以和生成的PIP3结合从而被活化,这些蛋白质中包含可以刺激细胞周期的FoxO蛋白质家族,以及可以增强葡萄糖代谢的蛋白质激酶D。另一个具有PH结构域的重要蛋白质是Bam32,它能够招募并激活例如Rac1和Cdc42这样的小GTP酶,通过调节肌动蛋白的多聚化,进行B细胞受体活化相关的细胞骨架活动。
恶性肿瘤中的B细胞受体
B细胞受体和许多B细胞来源淋巴瘤的发病机制相关。虽然抗原结合可能会诱发癌变B细胞的增殖,越来越多的证据表明不依赖于抗原的B细胞受体自发聚集是B细胞肿瘤形成的关键特征。 现在,B细胞受体相关的信号通路也是B细胞肿瘤的治疗靶点之一。
复制本文链接 文章为作者独立观点不代表本网站立场,未经允许不得转载。

 京公网安备
11010802036058号
京公网安备
11010802036058号
评论