星形胶质细胞,也称星状细胞(astrocyte、AS),为神经胶质细胞的一种。星形胶质细胞在大脑中的比例尚不明确。有研究发现,星形胶质细胞的比例因区域而异,占所有神经胶质细胞的20%至40%。它们执行着许多功能,包括形成脑血管障壁 (BBB) 的内皮细胞的生化支持、向神经组织提供营养、维持细胞外离子平衡、以及脑部和脊髓受损后的修复。自1990年代中期的研究表明,星形胶质细胞因回应刺激而远距离传播细胞间的Ca2+波,类似于神经元,以Ca2+的方式释放胶细胞递质 (Gliotransmitter) 。数据表明,星形胶质细胞还会通过谷氨酸的钙离子依赖性释放,向神经元发出信号 。这些发现使星形胶质细胞成为神经科学领域的重要研究领域。
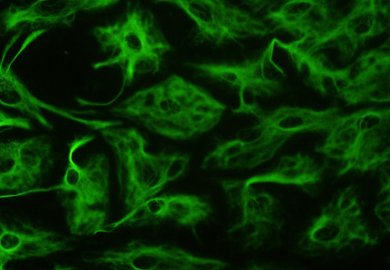
星形胶质细胞可在人工培养环境下以萤光方式显现,因为与其他胶质细胞相同,它们有表达胶质纤维酸性蛋白
构造
星形胶质细胞是中枢神经系统中神经胶质细胞的一种亚型。 它们的许多过程都包裹着神经元产生的突触。传统上会使用组织学分析去鉴定星形胶质细胞。细胞往往会表达中间丝状的胶质纤维酸性蛋白(GFAP) 。GFAP的上调往往代表着反应性星形胶质细胞增生 (reactive astrogliosis) ,即是中枢神经系统损伤中非常普遍的现象,其增生的轻重程度取决于损伤部位的病理、生理环境。
在中枢神经系统中,会存在着几种形式的星形胶质细胞,包括纤维状、原生质及放射状。纤维性星形神经胶质细胞 (星形胶质细胞I型) 通常位于白质内,细胞器相对较少,并表现出细长而无分支的细胞突起,细胞内有大量胶质丝。这种类型的星形胶质细胞通常具有“血管脚”,故而当它们靠近微血管壁时,它们会将细胞以物理形式连接到微管壁的外部。原浆性星形神经胶质细胞 (星形胶质细胞II型) 普遍见于灰质组织中,具有大量的细胞器,并表现出粗短而多分支的细胞突起,细胞内的胶质丝亦较少。在20世纪中期,透过电子显微镜分析,原浆型星形胶质细胞包裹轴突,而纤维性星形胶质细胞则与Ranvier节发生联系,2种亚型的星形胶质细胞均能在邻近的星形胶质细胞之间进行填充而形成连接,两种细胞均与血管发生广泛的联系。放射状星形神经胶质细胞 (伯格曼胶质细胞) 是自脑室区延伸至软脑膜之放射状突出物。
神经胶质细胞大多数只会在发育过程中出现,在神经元迁移的过程起一定的作用,惟视网膜的缪勒氏细胞和小脑皮层的放射状胶质细胞是一个例外,在成年期仍然存在。 当接近软膜时,所有形式的星形胶质细胞都会发出形成胶体神经胶质膜 (pia-glial membrane) 的突起。
存在于星形胶质细胞膜上的受体
星形胶质细胞乃透过钙来互相传递讯息。星状细胞因彼此之间有隙型连接(亦称为电性突触),因此讯息分子例如肌醇三磷酸(IP3)可以自由地由一个星状细胞扩散到另一个细胞。IP3引发的传讯路径会开启细胞内胞器上的钙离子通道,让钙离子进入细胞质。这些钙离子可能再促发更多IP3的产生。这个反应的净结果为创造一股钙离子波在细胞间传递。星状细胞于胞外释放三磷酸腺苷(ATP),并且活化其他星状细胞的嘌呤受体,在某些情况下也可能产生此种钙离子波。
缝隙连接蛋白43 (Cx43)是构成星形胶质细胞间缝隙连接的主要蛋白质,允许离子和分子量小于1 kD或直径小于1.5 nm的小分子物质 (如cAMP、IP3、H2O等) 自由扩散进入相邻的细胞,故而是细胞间物质和信息跨膜传递的重要通道。
活化态星形胶质细胞
正常情况下星形胶质细胞分为静止态、活化态和增殖态,三者相互转换构成了广义上的细胞周期。在正常的中枢神经系统中,静止态和活化态的胶质细胞并存。当受到损伤时,在细胞因子作用下,静止态的细胞逐渐向活化态转化。
功能
星形胶质细胞和神经元之间的代谢相互作用
星形胶质细胞帮助形成大脑的物理结构,并且积极发挥着许多作用,包括神经递质的分泌或吸收,以及对血脑屏障的维持。三方突触的概念已经被学者提出,指的是突触前元件、突触后元件和神经胶质元件之间在突触处发生的紧密关系。
结构方面 : 他们参与大脑的物理结构化。 星状细胞之所以得名是因为它们是“星形”的。 它们是大脑最多的神经胶质细胞,与神经元突触具有密切关系,负责调节脑内电脉冲的传输。
作为糖原储备:星状细胞含有糖原,并具有糖质新生的能力。 额叶皮层和海马中,神经元旁边的星形胶质细胞储存并释放葡萄糖,故而在高葡萄糖消耗率和葡萄糖短缺期间,星形胶质细胞可以为神经元提供葡萄糖。 部分学者对老鼠的研究表明,这种活动与体育锻炼之间可能存在着一定的联系。
大脑星形胶质细胞中,MPTP转化为MPP+的代谢反应
帮助代谢:它们为神经元提供营养,例如乳酸、葡萄糖等。超微结构研究显示,脑实质内所有的毛细血管都被AS的终足包裹,这一结构提示AS是脑部摄取血液葡萄糖的最初部位。虽然在生理条件下,脑部产生的能量约百分之九十至九十五被神经元所消耗,但是约百分之八十的脑葡萄糖利用正是在AS发生。葡萄糖需要在AS中酵解加工产生乳酸,以乳酸盐的形式为神经元提供能量。神经元兴奋时,可释放兴奋递质谷氨酸,榖氨酸与Na+通过星形胶质细胞膜受体进入细胞,同时Na+的升高激活Na+-K+-ATP酶,并且在葡萄糖转运蛋白的协助下,吸收葡萄糖并进行酵解,释放乳酸盐。AS具有在有氧条件下代谢葡萄糖生成乳酸的特性,称为有氧糖酵解。由于神经元自身的糖酵解能力较低,其乳酸主要来自于AS,AS与神经元之间存在着星形胶质细胞-神经元乳酸穿梭 (ANLS) 。
葡萄糖感测器:大脑中的葡萄糖水平检测也被星形胶质细胞所控制。星形胶质细胞在体外被低葡萄糖激活,后在体内被激活时,会增加胃内空置的空间,从而帮助消化。
血脑屏障:包围着内皮细胞的星形胶质细胞末端脚被认为有助于维持血脑屏障,但最近的研究表明它们并未发挥实质性作用。取而代之的是,大脑内皮细胞的紧密连接和基板在维持屏障中起著最重要的作用,惟最近发现以功能性磁振造影 (fMRI) 测量后的星形胶质细胞的活动与大脑中的血流有关系。
递质的摄取和释放:星形胶质细胞表达质膜转运体 (plasma membrane transporters ) ,例如谷氨酸、ATP和γ-氨基丁酸等几种神经递质的谷氨酸转运体。 最近的研究显示,星形胶质细胞会以囊泡、Ca 2 + 依赖性的方式释放谷氨酸或ATP ( 海马的星形胶质细胞在此方面存在争议。)
细胞外离子浓度的调节:星形胶质细胞高密度地表达钾离子通道。 当神经元活跃时,它们就会释放钾离子,从而增加局部细胞外的浓度。 由于星形胶质细胞对钾具有很高的渗透性,因此它们可以迅速清除细胞外空间中的过量积累物。 。如果该功能受到干扰,从戈德曼方程可知会导致钾在细胞外的浓度升高,导致神经元去极化。如果细胞外有钾的异常积累,会导致癫痫的神经元活动。在中枢神经系统中,星形胶质细胞通过L-谷氨酸-天门冬氨酸转运体 (GLAST) 和榖氨酸转运体 (GLT-1) 对细胞间隙的谷氨酸进行摄取,维持胞外正常的兴奋性神经递质浓度。持续高浓度的榖氨酸环境可促使小胶质细胞和星形胶质细胞NF-κB激活,诱导致炎基因合成使炎性反应扩大,成为许多神经系统炎性疾病及神经退行性疾病的病理机制。
神经链传导的调节:在下丘脑的视上核中,星形胶质细胞形态的快速变化会影响神经元之间的异突触传递 (heterosynaptic transmission) 。海马的星形胶质细胞通过释放ATP,以抑制突触传递,ATP被CD73外核苷酸酶水解成腺苷。 腺苷作用于神经元腺苷受体以抑制突触传递,从而增加了长期增强作用的动态范围。
血管调节:星形胶质细胞可以作为神经元调节血流的媒介 。
促进寡突胶质细胞髓鞘活动:神经元的电流使它们释放ATP,这是形成髓鞘的重要刺激。 ATP并不直接作用于寡突胶质细胞,反而它会导致星形胶质细胞分泌白血病抑制因子(LIF),可以促进寡突胶质细胞的髓鞘形成活性,表明星形胶质细胞在大脑中具有协调作用。
修复神经系统:中枢神经系统中的神经细胞受到损伤后,星形胶质细胞会填满空间,形成神经胶质疤痕上,可能有助于神经修复。 星形胶质细胞在中枢神经系统再生中的作用尚不清楚。 传统上将神经胶质瘢痕描述为再生的不可渗透的屏障,暗示了轴突再生 (axon regeneration) 的负面作用。 近年部分研究发现,星形胶质细胞是再生所必需的 。更重要的是,他们发现星形胶质瘢痕对于被刺激的轴突 (stimulated axons) 延伸穿过受伤的脊髓来说至关重要。当星形胶质细胞增生发生时,此可能对神经元有毒,释放出可以杀死神经元的信号。目前尚需更多研究来阐明它们在神经系统损伤中的作用。
长期增强作用:星形胶质细胞是否整合了海马体的学习和记忆能力引起部分学者的争论。 近年的研究发现,将人类神经胶质祖细胞移植到新生老鼠的大脑中会导致该细胞分化为星形胶质细胞。 这些细胞在分化后,不仅会增加了长期增强作用,还会改善老鼠的记忆力。
昼夜节律:仅星形胶质细胞就足以驱动老鼠SCN中的分子振动和昼夜节律行为,因此可以自主启动并维持复杂的哺乳动物行为 。
神经系统的开关:部分学者指出大神经胶质细胞(特别是星形胶质细胞)既是有损的神经递质容器 (lossy neurotransmitter capacitor) ,又是神经系统的逻辑转换器 (logical switch) ,故而胶质细胞会根据其膜状态和刺激水平阻止刺激传播,抑或使刺激沿着神经系统传播。
激活
外源性α-突触核蛋白
关于外源性α-突触核蛋白 (α-syn) 对星形胶质细胞的激活效应仅有少量文献提及,例如将神经元分泌的α-syn直接作用于星形胶质细胞,诱导炎症反应,刺激IL-6﹑IL-1β﹑ICAM-1的释放和CXCL10的表达。然而在星形胶质细胞中,α-syn诱导的TLRs激活罕有在文献中提及,有研究指出α-syn提高星形胶质细胞中核转录因子-κB (NF-κB) 的表达,与其对Toll样受体 (TLRs) 的诱导效应是一致的,进一步提示α-syn通过刺激星形胶质细胞,激活脑的固有免疫反应,从而为神经退行性疾病的致病机制的研究提供了有力的免疫学证据。
脂多糖
有研究指出,在老鼠腹腔内注射革兰氏阴性菌胞壁的主要成分脂多糖(LPS) 可以引起脑内星形胶质细胞的激活,迅速由静息状态转为激活状态,并且导致前炎症因子大量表达,前炎症因子可以再次激活更多的炎症免疫细胞,从而放大神经炎症过程,导致大量活性氧的产生,最终引起神经元凋亡及抑郁症的发生。
临床显著性
星状细胞瘤
星状细胞瘤是最常见的神经上皮性肿瘤,并且是从星形胶质细胞发展而来的脑肿瘤,神经胶质祖细胞或神经干细胞也可能引致星形细胞瘤。星形细胞瘤可发生在中枢神经系统的任何部位,成年人以幕上大脑半球居多,儿童则以幕下小脑常见。发生在幕上者以额叶及颞叶多见,有时甚至可以累积多个脑叶,亦可见于视神经,丘脑和第三脑室旁。幕下者则以小脑半球和第四脑室多见,亦可发生于蚓部和脑干。星形细胞瘤分为两类:低度(I和II)和高度(III和IV)。低度肿瘤属于分化不良的星形细胞瘤,在儿童中更为常见,此级别的肿瘤通常病程进展较缓,显微外科手术治疗预后亦较好;而高度肿瘤是多形性胶质母细胞瘤,在成人中更为常见,此级别的肿瘤通常恶性程度高 。
毛状星细胞瘤是I级肿瘤,被认为是良性和缓慢生长的肿瘤,通常具有充满液体的固体结节部分和结节,大多数位于小脑、第三脑室底部及靠近视神经附近,故而大多数症状与平衡或协调困难有关。它们在儿童和青少年中也更为常见。星细胞瘤属于生长相对较慢的II级肿瘤,为纤维状或原生质性星形细胞瘤 (Fibrillary or Protoplasmic astrocytomas),通常被认为是良性的,但会侵袭周围的健康组织,可以长成恶性肿瘤。它们在年轻人中更为常见。分化不良星细胞瘤 (Anaplastic astrocytoma) 被分类为III级并且是恶性肿瘤。 它们比低等级的肿瘤生长更快,并且倾向于侵入附近的健康组织。 分化不良星形细胞瘤的复发率比低等级肿瘤高,因此很难通过手术及放射线治疗彻底清除。多形性神经胶质母细胞瘤 (Glioblastoma Multiform、GBM ) 被分类为IV级并且是恶性肿瘤,可以包含一种以上的细胞类型,如少突胶质细胞等。尽管一种细胞类型可能会因特定治疗而死亡,但其他细胞类型可能会继续繁殖,并且扩散到附近组织,故而是胶质瘤中最具侵入性的类型。 大约50%的星形细胞瘤是多形性神经胶质母细胞瘤,很难治愈。
胶质瘢痕
当损伤和病变组织引起的反应超过了一定的程度或者长期慢性刺激就会引起As的过度增生,继而形成胶质瘢痕。胶质瘢痕封闭病变组织,防止微生物感染和细胞损伤蔓延。胶质瘢痕同时亦产生CSPG生长抑制因子,会阻止轴突生成和神经发生。胶质瘢痕的形成最终阻碍轴突再生,导致神经功能不能恢复。神经系统疾病如阿尔茨海默病及癫痫等的发生和发展,以及脑血管病或脑外伤的发生均伴随胶质瘢痕的形成。
神经发展障碍
神经发展障碍在有关领域上出现了一个相对较新的方向。这种观点指出,星形胶质细胞功能障碍可能在某些精神疾病,如自闭症光谱(ASDs)和精神分裂症等的神经回路畸变中起到一定的作用。
其他病理
阿兹海默症患者体内的星形胶质细胞
涉及星形胶质细胞的其他重要临床病理学包括星形胶质细胞增生和星形细胞病变 (astrocytopathy)。 这些的例子包括多发性硬化 (MS) 、抗AQP4 + 视神经脊髓炎、罗氏脑炎、亚历山大症和肌萎缩性脊髓侧索硬化症。研究表明,星形胶质细胞可能隐含在神经退化性疾病中,例如阿兹海默症、柏金逊症、亨丁顿舞蹈症及渐冻人症中。
培养
星形胶质细胞的培养模式主要有原代星形胶质细胞培养、直接分离培养体内成熟的星形胶质细胞,以及神经干细胞分化三种方式,其中又以第一种方式的使用范围最广阔。形态学实验和免疫萤光结果显示,原代星形胶质细胞具有分裂迅速、胞体较大、分枝较少且GFAP表达量较高的特点。这与高度分化的反应态星形胶质细胞状态类似。而神经干细胞分化而来的星形胶质细胞基本则不具分裂能力,胞体相较于原代细胞小且分枝多,GFAP表达量亦低。这与分化早期的静息态星形胶质细胞状态类似。这表明原代星形胶质细胞处于反应态,而分化的星形胶质细胞则未进入反应态。因为原代星形胶质细胞中GS、xCT、N-甲基-D-天门冬胺酸、脂蛋白酶和GFAP等基因的表达水平显著地高于分化的星形胶质细胞。
研究
罗彻斯特大学的一组科学家于2010年11月进行了一项研究,试图通过替换神经胶质细胞来修复成年大鼠中枢神经系统的创伤。当将神经胶质细胞注射成年大鼠的脊髓损伤位置时,星形胶质细胞通过将人类神经胶质前体细胞暴露于骨塑型蛋白而产生(骨塑型蛋白可以在整个人体中形成组织结构)。这促进了轴突生长,脊髓板层神经元的存活亦明显增加。另一方面,神经胶质前体细胞和这些细胞通过与纤毛状神经营养因子接触而产生的星形胶质细胞,未能促进神经元存活,反而在损伤部位上促进轴突生长。
有研究涉及了两种类型的海马体神经元培养物,在第一种培养物中,神经元是从一层星形胶质细胞生长而来的,而另一种培养物则不与任何星形胶质细胞接触,而是用具神经胶质条件的培养基(GCM) 。它会抑制培养的星形胶质细胞在大鼠大脑中的生长。在从一层星形胶质细胞生长的培养物中,星形胶质细胞对长期增强作用 (LTP) 具有直接的作用,而在GCM培养物中则没有。研究表明,星形胶质细胞在神经干细胞的调节中起重要作用。哈佛大学的一份研究表明,人类脑部中有大量神经干细胞,通过来自星形胶质细胞的化学信号保持休眠状态。星形胶质细胞能够通过抑制Ephrin A2和Ephrin A3的释放来激活干细胞转化为可运作的神经元。
威斯康辛大学的一组研究人员在2011年《自然-生物技术》上发表的一项研究中提到,它已经能够指导胚胎干细胞和受诱导的人类干细胞成为星形胶质细胞。在2012年,一项大麻对短期记忆影响的研究发现,四氢大麻酚激活星形胶质细胞的大麻受体第一型受体,从而导致AMPA受体从相关神经元的细胞膜上被去除。
分类
解剖学分类法
原生质的:在灰质中发现,有许多分支的细胞突起,其末端脚包裹着突触。侧脑室附近的SVX内祖细胞会产生一些原浆性星形胶质细胞。
Gömöri阳性星形胶质细胞:即原浆性星形神经胶质细胞的子集,其中包含许多细胞质内含物或颗粒,它们被铬明矾苏木精 (chrome-alum hematoxylin) 染色后呈阳性。这些颗粒是由溶酶体内,被吞噬的变性线粒体的残余物形成的。某些类型的氧化应激似乎是这些特殊星形胶质细胞内线粒体损伤的原因。与其他大脑区域相比,下丘脑弓状核和海马体中Gömöri阳性星形胶质细胞丰富得多。它们可能在调节下丘脑对葡萄糖的反应中起到一定的作用。
纤维状的:存在于白质中,表现出细长而 无分支的细胞突起,其末端脚包着Ranvier节。 放射状胶质细胞也可产生一些纤维状星形胶质细胞。
转运蛋白/受体分类法
GluT类型:这些表达了谷氨酸转运蛋白(如EAAT1 / SLC1A3/ EAAT2 / SLC1A2),并且通过转运蛋白电流,响应谷氨酸的突触释放。 EAAT2的功能和可用性受人类星形胶质细胞中的受体TAAR1所调节。
GluR类型:这些表达了谷氨酸受体(主要是代谢型麸胺酸受体和AMPA受体类型),并通过通道介导的电流和肌醇三磷酸依赖性的Ca2+暂态来响应谷氨酸的突触释放。
复制本文链接 文章为作者独立观点不代表本网站立场,未经允许不得转载。

 京公网安备
11010802036058号
京公网安备
11010802036058号
评论