东京大学干细胞和再生医学研究中心的科研团队在顶级期刊 Science 发表了题为 Functional primordial germ cell–like cells from pluripotent stem cells in rats 的研究文章,通过层层攻关,在前期解析大鼠生殖系发育层面内在分子机制的基础上,他们这次成功地利用大鼠多能干细胞诱导产生了功能性的原始生殖细胞样细胞(PGCLCs),将这些 PGCLCs 被移植到无生殖细胞大鼠的输精管中,能够产生有功能的精子,进而产生健康的后代。
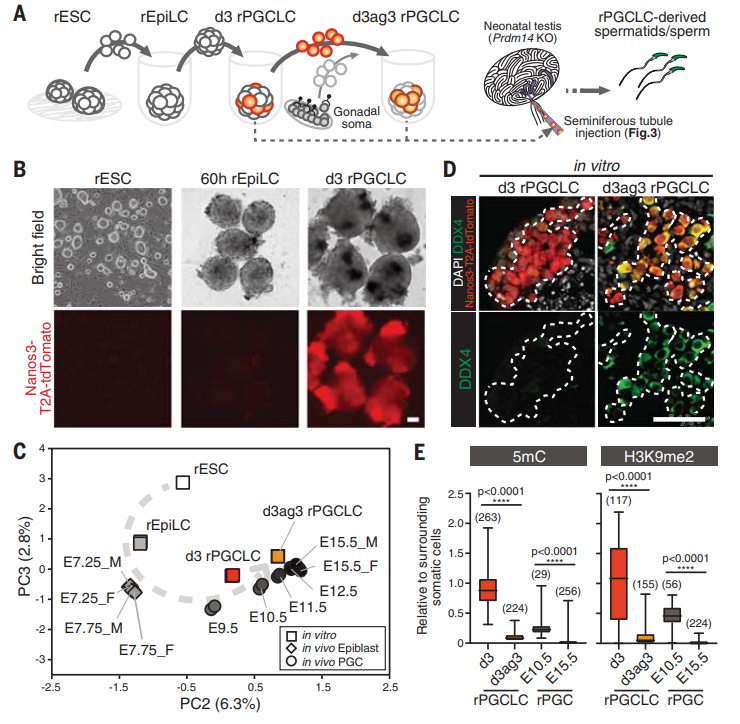
在哺乳动物中,原始生殖细胞(PGCs),是精子和卵子的前体,产生于前肠胚。前期的研究使用转基因小鼠等工具已经揭示了对 PGCs 命运决定至关重要的关键信号通路和转录调节因子。然而,早期胚胎发育中数量较少的 PGCs 限制了领域内对其进入特化生殖细胞的特定时间窗口的认识。 主要研究内容 在胚胎着床后,大鼠的胚泡会形成一个卵柱结构,包含一个多能的外胚层,而生殖细胞即由此产生,这与小鼠胚泡类似。因此,研究人员首先测试了是否可以使用前期已经建立的小鼠培养条件来实现大鼠多能干细胞(rPSCs)向上皮样细胞(EpiLC)的命运转换。 为了监测从多能性状态的转变,他们使用了 Prdm14-H2BVenus 标记的大鼠胚胎干细胞(rESCs),Prdm14-H2BVenus 特定标记 naïve 多能性外胚层和 ESCs,而不是胚胎植入后形成的外胚层。经过 72 小时的培养,染色结果显示 Prdm14-H2BVenus 的水平降低,OTX2(植入后的外胚层标记物)和 CD47(在小鼠外胚层干细胞中表达上调的质膜标记物)的水平升高,核心多能因子 OCT3/4 的水平保持稳定。 随后,为了研究培养后产生的大鼠上皮样细胞(rEpiLCs)整体基因的表达情况,他们对 rESCs 和 rEpiLCs 进行了全转录组测序,两者的差异分析结果显示,两组均包含了 naïve 或 primed 两种状态相关的基因。结合上述的实验结果,他们证实了 naïve rESCs 诱导的球形聚集体中的 rEpiLCs 再现了体内植入后外胚层的特征。 接下来,他们使用分离的 rESCs 在 EpiLC 培养基中培养 48~72 小时以形成聚集物,随后这些聚集物被转移到含有 BMP4 的 PGC 样细胞(PGCLCs)培养基中,BMP4 是对 PGCs 命运决定至关重要的细胞因子。在 PGCLC 培养基中培养 2 天后,聚集物中的一部分细胞开始表达 Nanos3(高度保守的生殖细胞标记基因)。 他们随后对培养第 3 天 rPGCLCs(d3 rPGCLCs)进行转录组测序,并将其与 rESCs、rEpiLCs、体内大鼠外胚层、rPGCs 的转录组进行比较。主成分分析(PCA)结果反映了外胚层在体内和体外向生殖系命运的转换。第 3 天的 rPGCLCs 中表达了所有的 PGC 特异性基因和多能性基因,而晚期 PGC 标记物的表达低于 E15.5 性腺 rPGCs。因此,他们推断诱导的 rPGCLCs 可能相当于体内 rPGCs 的迁移期。 由于 PGCs 在发育过程中经历了广泛的表观遗传重编程,他们还检测了培养细胞中的 DNA 甲基化和组蛋白甲基化的动力学变化。结果发现,培养过程中表观遗传变化的动态与体内 rPGCs 发育密切相关,提示 d3 rPGCLCs 随着表观遗传重编程的逐步进行,在体外向性腺阶段渐渐成熟。 最后,他们研究了体外诱导产生的雄性 rPGCLCs 移植到体内后是否能够产生有功能的精子。 他们将 rPGCLCs 移植到完全缺乏内源性生殖细胞的 Prdm14 敲除新生大鼠的生精小管中,在移植后 8~11 周,他们检测发现了在移植睾丸的输精管中示踪基因的表达。与此同时,在组织切片中,他们也观察到圆形精子细胞和成熟精子,这些结果表明 rPGCLCs 可以在体内完成精子的发生和成熟过程。 紧接着,他们通过将诱导产生的圆形精子细胞和成熟精子分别注射到未受精的大鼠卵母细胞中,用来证实 rPGCLCs 衍生的睾丸生殖细胞的发育潜力。 在移植足月后,分别有 18 和和 6 只健康的大鼠后代出生,并可发育成具有生育能力的正常成年大鼠。因此,这些结果表明体外诱导的 rPGCLCs 具有产生功能完全的成熟配子的能力。


复制本文链接 文章为作者独立观点不代表本网站立场,未经允许不得转载。

 京公网安备
11010802036058号
京公网安备
11010802036058号
评论