21世纪的第一个十年,一枚叫做iPS细胞的重磅炸弹引爆整个医学界。
2006年,日本京都大学山中伸弥教授向小鼠皮肤细胞中植入4个病毒,成功诱导出具有万能分化性的细胞,即iPS细胞(诱导多能干细胞)。2012年,山中伸弥因发现“成熟细胞可被重写成多功能细胞(即iPS细胞)”而与约翰·格登爵士一同荣获2012年诺贝尔生理学或医学奖。
自此,大规模关于iPS的研究在全球范围内全面展开,iPS细胞登上神坛。

什么是iPS细胞?如何获得iPS细胞?iPS细胞有什么作用?未来它的命运如何?
1 什么是iPS细胞?
IPS细胞(induced pluripotent stem cells, iPS cells)是日本人山中申弥(Shinya Yamanaka)通过研究对人体组织的细胞进行重新编程而得到的类似胚胎干细胞的一种细胞类型。这种细胞酷似人类的胚胎干细胞,具有超强的分化能力。可以分化出这个人的血细胞,骨细胞,神经细胞等,进而培养出这个人的脏器,骨头,眼角膜,胰腺等。
分化后用途例如:可以诱导iPS细胞分化为胰岛β细胞,用于治疗糖尿病。它们还可以被诱导为血液细胞治疗白血病,或神经元治疗神经系统疾病。
2 iPS干细胞是如何产生的?
iPS可以根据其类型以多种方式制造出来。一种方法是遗传重编程。一些实验室将正常细胞(如皮肤细胞)少数基因重新编程为IPSC。山中伸弥2006年利用病毒载体将四个转录因子(Oct4, Sox2, Klf4 和c-Myc)的组合转入分化的体细胞中,使其重编程而得到的类似胚胎干细胞的一种细胞类型。接着世界各地不同科学家陆续发现其它方法同样也可以制造这种细胞。
3 iPS细胞与ES细胞的区别?
首先IPS可以根据其类型以多种方式制造出来。一种方法是遗传重编程。一些实验室将正常细胞(如皮肤细胞)少数基因重新编程为IPSC。 例如2006年山中伸弥教授的“四病毒诱导法”以及2013年邓宏魁教授的“三因子转录法”。
iPS细胞的一个优点是它们可以在不需要人类胚胎的情况下创造,不会引发社会的伦理问题和争议。另一个好处是iPS干细胞可以通过CRISPR / Cas9基因编辑产生同基因对照细胞系。该基因编辑可以改变DNA达到使用细胞治疗人类疾病的目标。
而胚胎干细胞(ES细胞)是一种类似于iPS细胞的多能干细胞,但不同之处在于它们是从早期胚胎中收集的,称为胚泡。与iPS细胞相似,ES细胞在实验室中进行处理,使其发育成ES细胞系。这种方法通常用于研究目的,它有助于研究人员了解干细胞如何分化和表现。

自1998年科学家首次获得人类胚胎干细胞至今20年,它作为再生医疗的细胞来源备受期待。然而,胚胎干细胞存在多个备受争议的难题——遗传背景问题、污染问题,而最大的障碍就是用人类受精卵培养的伦理问题。这些难题对于干细胞的研究是极大的局限。
iPS细胞技术为这些难题提供了一个完美的解决方案。研究人员可以用一个人的皮肤细胞、血细胞或者其他细胞进行重新编码,将它们转化为iPS细胞,进而分化为干细胞、神经细胞或是其他任何需要再生的细胞。这种个性化的疾病治疗方法不仅可以规避免疫排斥的风险,还能避免使用胚胎干细胞带来的伦理方面的争议。
4 iPS细胞是否有可能用于医疗应用?
iPS可用于再生医学,筛选和开发新药,以及了解不同类型的疾病。例如,在创造新药物时,研究人员可以使用培养的干细胞来测试药物并帮助他们了解其治疗可能性。
由于干细胞样本取自患者本身,因此免疫排斥也被最小化。这个优点为iPS创造了一个巨大潜力的应用,有助于推动治疗药物的研究开发。
5 iPS细胞是哪一种细胞?
我们的身体最初是单个细胞,即“受精卵”。受精卵重复细胞分裂几次,并生长成可以被转化为人体任何部位的细胞聚集体,称为“早期胚胎(受精后几天内的胚)”。之后,一部分变为皮肤,另一部分变为骨骼,神经细胞等。
一旦它开始变成人体某个地方的细胞,它就不会再变成另一个细胞。例如,无论细胞分裂重复多少次,已经变成皮肤的细胞都会变成皮肤细胞。它是“单向”,不能像骨骼和神经那样是其他细胞。

它可以像倒转时钟指针一样倒回细胞的时间,将其初始化为受精卵状,并创建可以是任何细胞的细胞,例如心脏,皮肤,骨骼,神经和血液。如果我能……。除了适用于修复失去的器官和身体功能的“再生医学”之外,阐明生命的诞生和成长的机理将导致新药物和新治疗方法的研究和开发。
在全世界范围内进行此类研究的同时,山中教授和他的同事们将四个基因放入已经成为人体一部分的细胞(如皮肤)中,并将其生长成各种组织和器官的细胞。我们发现,我们可以创建具有像早期胚胎细胞一样生长的细胞,并且可以无限期地生长。这些是“诱导多能干细胞”,或简称为iPS细胞。
6 日本首次尝试利用iPS细胞治疗癌症
据当地媒体22日报道,日本研究人员日前实施了一台移植免疫细胞治疗癌症的手术,用于移植的免疫细胞由诱导多能干细胞(iPS细胞)培养而来。这是日本首次尝试利用iPS细胞治疗癌症。
据日本共同社等22日报道,千叶大学理化学研究所的一个研究小组本月14日对一名头颈部恶性肿瘤患者实施了自然杀伤T细胞(NKT细胞)移植手术。手术采用注射形式,向患者癌组织附近血管一次注射约5000万个NKT细胞。首次注射后患者情况良好,患者还将接受两次注射。
NKT细胞是一种可对癌细胞发动高效攻击的免疫细胞,但人体内仅有少量这种细胞。研究人员从健康人的血液中采集NKT细胞并培育出iPS细胞,再使iPS细胞分化增殖出大量NKT细胞后注入患者体内。
iPS细胞是通过对成熟体细胞“重新编程”培育出的干细胞,拥有与胚胎干细胞相似的分化潜力。
研究小组计划2022年3月前对4至18名接受标准治疗后病情复发的头颈部恶性肿瘤患者进行同样的免疫细胞移植手术,以确认这种疗法的安全性和有效性。
7 世界首例iPS细胞治疗脊髓损伤
2019年2月18日,日本政府通过日本庆应大学关于利用iPS细胞诱导成的神经干细胞移植到严重脊髓损伤患者的临床研究申请。这项临床会招募4名成年严重脊髓损伤的患者进行治疗。预计最早将于今年秋季左右实施第一例移植手术。

在此次治疗中,研究人员将通过使用iPS细胞转化为作为神经细胞基础的细胞,每次移植约200万个新神经细胞到患者的受伤区域来进行治疗,作为额外防御措施,研究人员还会采用免疫抑制药物以防止移植细胞的排斥。
8 世界首例iPS人工角膜移植成功
2019年7月,全球首例利用iPS细胞培养出的角膜组织移植手术在日本顺利完成。使用iPS技术培养制备的角膜片层里含大约300-400万个角膜细胞,与健康人眼中的角膜细胞数量相同。
接受移植的是一名患有重度“角膜上皮干细胞衰竭症”的女性,术后患者视力有所改善,并于8月出院。研究小组表示,将用一年时间跟踪观察移植的安全性和效果。
近日,美国食品药品监督管理局(FDA)正式批准Fate公司在研疗法FT596的研究性新药申请。FT596原子克隆株诱导多能干细胞系,是该公司首个现成的CAR-NK细胞免疫疗法,靶向多种肿瘤相关抗原。
Fate公司认为大部分患者在进行细胞疗法时,对自体或者异体来源的细胞需求量都是非常庞大的,这将导致细胞疗法的成本昂贵、耗时较多以及产品的品质难以控制。只有iPSC来源的细胞疗法才能满足需求,这将有可能改变免疫细胞疗法的市场游戏规则。
10 iPS细胞体外生成毛囊细胞
6月27日,美国Sanford Burnham Prebys医学研究所的科学家利用iPS细胞开发了一种让皮肤重新生长头发的方法,通过iPS技术诱导出真皮乳头间叶细胞(位于毛囊底部的细胞,能诱导头发形成),这项试验已在小鼠身上得到了验证。
11 iPS细胞体外生成睾丸间质细胞
今年7月,《PNAS》杂志刊登了加拿大麦吉尔大学和美国南加州大学Papadopoulos团队一项新的研究成果。研究人员在实验室中成功将人iPS细胞转化为产生睾酮的睾丸间质细胞,为个性化细胞治疗低睾酮患者铺平了道路。
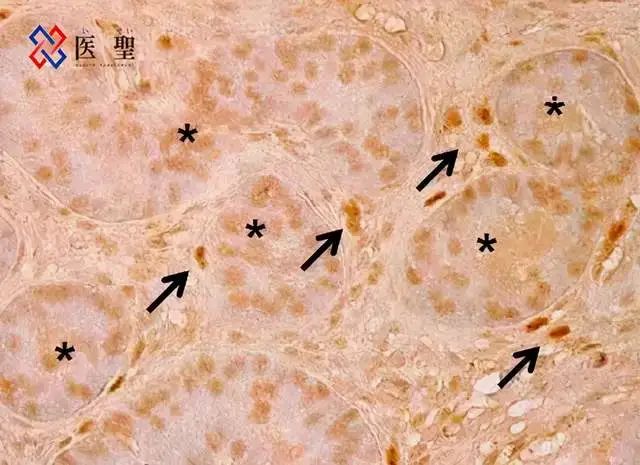
箭头所指为人体组织中的睾丸间质细胞
接下来,Papadopoulos与团队成员将测试制造出的睾丸间质细胞功能,并尝试将其移植到性腺功能减退症动物模型中。他们还希望比较使用正常男性与性腺功能减退症男性患者皮肤细胞制造出的睾丸间质细胞,以更好地了解这种疾病。
12 iPS细胞治疗老年黄斑变性致盲
2014年,日本高桥雅代(Masayo Takahashi)研究团队使用患者自体细胞衍生的iPS细胞治疗了一名AMD患者。这名患者在首次就诊前2个月进行了双眼白内障手术,但病变并没有得到好的控制,疾病持续的发展着。高桥雅代研究团队使用iPSCs,分化出了RPE细胞,进而将细胞制备成了一个1.3mm×3.0mm的薄片。
该年9月,研究人员将细胞片移植给了患者右眼。在术后3个月的时候,研究人员终于在患者的右眼中发现了大量存在的功能性RPE细胞,通过干细胞治疗成功阻止了疾病的进展!
13 iPS细胞体外生成“人工肝脏”
2019年5月,由东京医学和牙科大学教授领导的研究小组用iPS细胞培育出了直径只有约0.2毫米的肝脏组织——“迷你肝脏”,可在体外再现肝炎病症并用于试验相关药物。这次的试验也标志着这种“器官”首次由iPS细胞制成。
科研人员表示,通过从iPS细胞创建'微型器官',可以重现疾病的状态,是一种可以适用于未来肺部或肠道疾病的技术。
干细胞是现在整个生命科学的最前沿,而且是未来应用中大家最关注的一个学科,无疑将来会引起一场新的医学革命。iPS细胞的出现,让再生医学界摆脱了胚胎干细胞研究相关的伦理桎梏,在短短的十年时间之内就从实验室走向了临床应用,造福于人类。虽然目前的科技水平仅能利用iPS细胞在体外形成细胞团或者人体组织,直接在体外培育成肢体甚至器官仍然任重道远。
人类已经前所未有的接近了永生的梦想,而iPS细胞是否会成为打开那道门的钥匙?让我们拭目以待!
复制本文链接 文章为作者独立观点不代表本网站立场,未经允许不得转载。

 京公网安备
11010802036058号
京公网安备
11010802036058号
评论