前言
回顾过去几百年人类发展的历史,19世纪是以蒸汽机为代表的工业革命世纪,20世纪是以计算机和通信为代表的信息技术的时代,而21世纪将是以生物技术为代表的生命科学与技术的世纪。

干细胞技术是生物技术的核心内容之一。基于干细胞的再生医学或组织再生治疗是继药物治疗和手术治疗之后的又一次医疗技术革命,干细胞治疗在疾病的康复阶段具有更加重要的意义。随着科学人员的不断探索,糖尿病、心脏病、阿尔兹海默症等难治性疾病的治疗也迎来了新的希望。
而在用干细胞治疗疾病中应关注治疗时机、给药途径、细胞类型选择、使用数量等多种问题。在多因素之间找到最佳的可行方案,方能助力这项技术更快落地应用。
当临床应用干细胞治疗时,选择哪个代次的干细胞治疗更加合适,是经常容易被问及的。这些都是应该思考和有待解决的问题。我们都是知道,人分男女老少,而干细胞也有年轻和衰老之分,因此,细胞的代数是影响干细胞活性及临床有效性、安全性的一个重要因素。
细胞培养的主要方式是原代与传代培养。理论上讲,细胞代数越靠前,干细胞的干性也越强。但是干细胞在体外培养的过程中,干细胞有从组织微环境到体外培养环境的一个调整和适应过程,一部分不适应的细胞会被淘汰,所以在前两三代,干细胞基因组有着不稳定的因素,可能不宜临床应用。
有研究显示,通过核型分析发现,在前三代细胞中,干细胞存在异常核型的比例偏高。就如间充质干细胞(mesenchymal stem cells,MSCs)而言,临床应用的最佳代数应该在4~6代。
目前临床研究中,MSC应用较为常见的来源骨髓、脂肪、脐带、胎盘等,本文以脐带、脂肪、胎盘这三类比较常见的来源进行总结,针对不同来源间充质干细胞,体外传代培养后不同代次的一些生物学特性的变化(例如:细胞形态、细胞周期检测、表面标记物检测、染色体核型分析、相关基因表达及细胞因子的定量分析),因可供参考资料有限,不足之处请谅解。
脐带
在各类不同来源的间充质干细胞中, 人脐带来源间充质干细胞(human umbilical cord mesenchymal stem cells,hUC-MSCs)作为更为“年轻”的成体间充质干细胞,具备有出生前和出生后MSC的综合优点而受到越来越广泛的关注。
人脐带间充质干细胞长期体外传代培养后其基本的干细胞生物学属性, 如细胞表面免疫标志物和诱导多向分化潜能, 无显著性改变。长期培养至20代, 未发现致病性或致瘤性基因变异。高代次(P20)hUC-MSCs的细胞增殖活性和端粒酶活性与早期低代次(P5)细胞无显著性差异。随着培养代次的增加, 细胞开始出现老化, 尤以20代细胞表现最为明显。
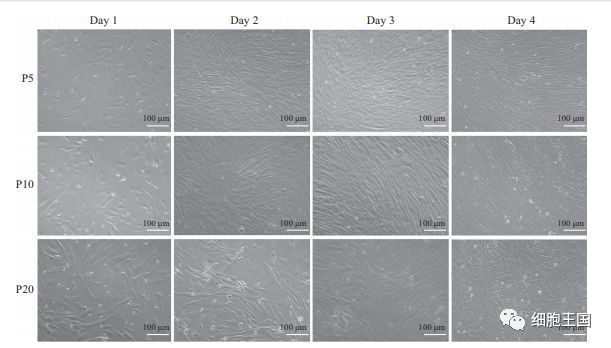
同代次人脐带间充质干细胞的形态学观察
体外传代培养至第5、10代hUC-MSCs呈现完全相同的细胞形态与生长排列方式, 均呈现长梭状贴壁生长, 轻度螺旋流水状排列。第20代细胞呈现非常相似的长梭状贴壁生长, 但胞体略显增大, 融合后局部排列紊乱。
已有研究显示, 虽然高代次培养的hUC-MSCs染色体组型依然保持稳定,但至第7代时其端粒酶活性会有所下降。我们通过检测人端粒酶逆转录酶活性亚单位基因的表达显示, 第5、10和20代hUC-MSCs的端粒酶活性之间并没有显著性差异; 且不同代次细胞呈现相似的生长增殖曲线, 表明它们的细胞增殖活力也无差异性。
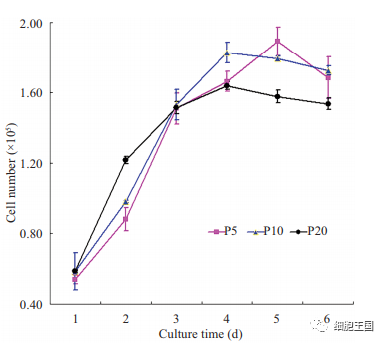
不同代次人脐带间充质干细胞的增殖活性检测
不同代次(第5、10、20代)的hUC-MSCs以同样密度接种于6孔培养板中, 每天分别收集3孔不同代次的hUC-MSCs计数绘制生长曲线。图示代表3次重复实验。
除此以外,因专业性较强及篇幅有限,类似(常规核型分析、染色体核型分析、表面标记物检测、基因表达和细胞因子定量分析)就不再赘述了。总言之,虽然第20代hUC-MSCs依然保持与低代细胞类似的干细胞生物学属性、基因稳定性和生长特征, 随着传代培养时间的延长, 细胞开始呈现一定程度的老化现象。鉴于过度的传代培养会导致hUC-MSCs出现老化征象, 建议用于干细胞临床治疗的hUC-MSCs体外培养最好不超过第10代(现在大多数实验室基本上都能做到3代以内,当然也许只是嘴巴上这么说)。
胎盘
间充质干细胞来源丰富,胎盘间充质干细胞同样具备取材方便等优势,足月的胎盘是胎儿娩出后的废弃物,容易获得并且体积大获得的数量多,科研成本低廉,不涉及社会、伦理等问题,而且胎盘间充质干细胞有类似于骨髓间充质干细胞的功能和特性,并且具有优于骨髓间充质干细胞的增殖能力,能够大量扩增间充质干细胞的数量。
有研究分别对P5、P10和P15代细胞的增殖能力进行了检测,结果显示P5代间充质干细胞的增殖能力明显高于P10和P15代,实验结果表明,胎盘间充质干细胞在体外培养时,随着细胞代次的增加,细胞会逐渐出现的老化。由于胎盘干间充质细胞在P5代后增殖能力会逐渐的下降,所以作为临床应用时最好选择P5代以下的间充质干细胞进行体外培养。
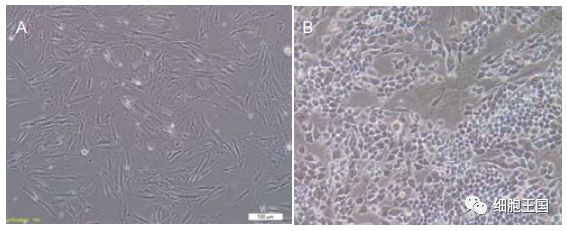
胎盘间充质干细胞镜下形态
图注:图中 A 为细胞贴壁后形态均一,呈长梭形,平行或漩涡状生长(×100);B 为第 25 代细胞形态呈铺路石样改变 (40×4)。
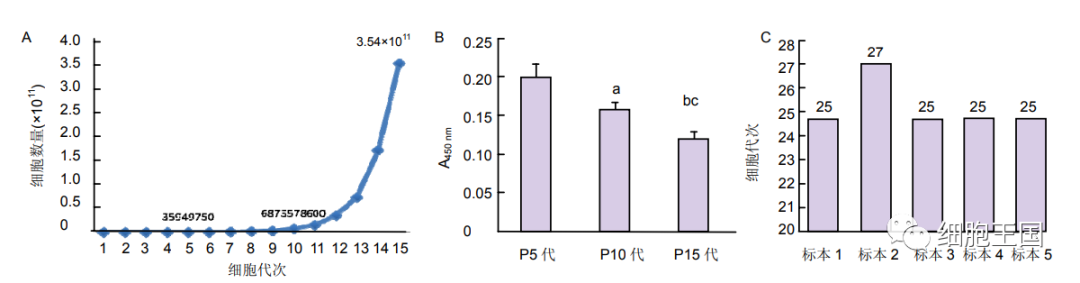
胎盘间充质干细胞生长曲线、增殖能力及传代结果
图注:图中A为P5代细胞的倍增时间明显短于P10代和P15代细胞的倍增时间;图B为不同代次的胎盘间充质干细胞增殖能力不同,P5代增殖能力明显高于P10和P15代,与P5代比,aP
在该项研究中,胎盘间充质干细胞可以长期传代到第 25 代,不同代次的胎盘间充质干细胞增殖能力不同,P5代增殖能力明显高于 P10 和 P15 代,揭示了临床应用应以P5 代之前为宜。
脂肪
脂肪间充质干细胞 (adipose derived mesenchymal stem cells,ADSCs)是一类存在于脂肪组织 中具有多向分化潜能的干细胞。细胞来源更加丰富、取材更为方便。而且其免疫原性很低,体外扩增也较加容易,这些优点使其在组织工程、创面修复和基因治疗等方面具有了更加良好的应用前景。
有研究对ADSCs进行体外培养至 1、3、5、7、l0、14和 15代,发现ADSCs传代至第7代后,细胞增殖速度开始减慢 ,10代后细胞增殖速度显著减慢。细胞形态为长梭形并保持稳定。
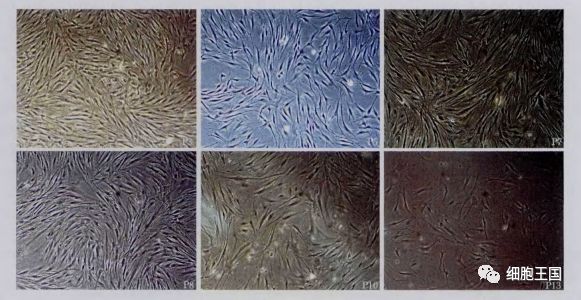
细胞形态观察
染色体细胞核型没有明显易位和缺失等变化,相关基因表达量略有差异,培养基内分泌的细胞因子保持稳定。

细胞因子定量分析
研究表明(利用无血清培养基培养的)脂肪间充质干细胞在传代至5代的过程中,生物学特性及遗传特性基本稳定,没有明显变化。初步揭示了脂肪间充质干细胞体外传代至第5代以内可以安全使用 。
通过以上研究不难看出,间充质干细胞理论上可以长期传代培养,但在临床应用中不建议选择代次较高的干细胞批次。未经体外扩增的MSC,细胞本身是安全无害的,除非本身有某种基因缺陷,体外扩增最大的风险在于基因突变。有一研究小组发现骨髓MSC体外培养至18代时,出现基因突变、染色体异常。其他大量的研究证实,MSC在体外培养代数过高(超过10代)的情况下才会引起染色体异常。
在以往的文章中也有提到,另一个影响干细胞回输安全性的问题是添加物,如使用无血清培养基代替动物血清培养;通过严格的无菌操作避免抗生素的使用。但对于胰酶等细胞培养不可替代的成分,要在回输时严格质检以确保其无成分残留,也是至关重要的。
间充质干细胞作为细胞制剂的效应成分,其本身的安全性问题不容忽视;细胞制剂在生产制备过程中的质量控制体系,也同时影响着其回输安全性。
参考资料:
[1] 体外培养传代人脂肪 、脐带、胎盘间充质干细胞的遗传特性比较研究
[2] 长期传代培养对人脐带间充质干细胞生物学特性的影响
[3] Best practices in cell culture: an overview
[4] 胎盘间充质干细胞传代后的增殖能力
[5] 人脂肪间充质干细胞体外传代的遗传特性分析
[6] Stability of human mesenchymal stem cells during in vitro culture:considerations for cell therapy
复制本文链接 文章为作者独立观点不代表本网站立场,未经允许不得转载。

 京公网安备
11010802036058号
京公网安备
11010802036058号
评论