01
疾病介绍
动脉粥样硬化是一种通过适应性免疫和先天免疫介导的动脉壁复杂慢性炎症性疾病,是由于动脉壁斑块的积聚和硬化导致动脉狭窄,从而限制血流。动脉粥样硬化是心血管疾病的主要病因,是全球发病率和死亡率的主要原因之一。
动脉粥样硬化的慢性发病过程涉及动脉壁脂蛋白积聚、内皮细胞损伤和功能障碍以及免疫系统异常激活。血管内皮细胞、平滑肌细胞和免疫细胞参与并促进了动脉粥样硬化各个阶段的形成、进展和破裂。
动脉粥样硬化的发病机制与多种因素有关,这些因素不仅包括传统风险因素,如血脂异常、肥胖、糖尿病、高血压、老龄化和吸烟,还包括非经典风险因素,如感染和慢性炎症疾病[1]。
02
动脉粥样硬化
血管慢性炎症的后果
动脉粥样硬化是一种与衰老相关的慢性血管炎症性疾病,单核细胞发育分化而来的巨噬细胞是斑块形成的主要驱动因素。低浓度oxLDL刺激单核细胞,可以导致单核细胞的表观遗传组蛋白修饰改变,从而转变为诱导持久的致动脉粥样硬化的巨噬细胞表型,其特征是促炎细胞因子产生和泡沫细胞(foam cell)形成增加[2]。
脂蛋白a是促炎氧化磷脂(OxPLs)的主要载体,同样能诱导单核细胞转变为促炎的巨噬细胞表型[3]。氧化低密度脂蛋白(oxLDL)通过TLR4和尿激酶受体(uPAR)介导的NF-κB信号分子通路诱导动脉粥样硬化斑块血管平滑肌细胞表达G-CSF、GM-CSF、IL-1β、TNF-α、MCP-1和MMP-2,从而产生和维持低水平的血管慢性炎症[4-6]。
最小修饰的低密度脂蛋白可导致动脉粥样硬化病变中含有肉眼可见的胆固醇晶体沉积,同时引发巨噬细胞中的NLRP3炎症体启动和激活,同时伴随着巨噬细胞白介素等炎症因子,反馈性加重动脉粥样硬化病变[7]。所以,减少体内脂蛋白a和氧化低密度脂蛋白,有利于阻断动脉粥样硬化病变。
使用FDG正电子发射断层扫描(PET)方法,发现人类动脉粥样硬化斑块中的糖代谢增加,尤其是炎症细胞浸润和富含脂质的坏死核心区域[8, 9]。动脉粥样硬化斑块区的细胞糖代谢出现了异常,以糖酵解途径为主产生ATP[10, 11]。
在患者来源的单核细胞和巨噬细胞中,增加的葡萄糖摄取和糖酵解通量促进线粒体活性氧物种的生成,进而促进糖酵解酶丙酮酸激酶M2(PKM2)的二聚化并使其能够进行核移位,从而促进IL-6和IL-1β的产生,因而糖代谢异常和氧化应激增强是一种慢性炎症状态[12]。
但是本笔者认为斑块区域细胞的糖代谢以糖酵解为主是细胞应对斑块区域微环境的自身调整的变化,是结果,不是原因。当然,如果能改善细胞的代谢水平,也是可以提高细胞的功能。
虽然这些研究表明胆固醇的积累会引起促炎反应,但是也有研究显示巨噬性泡沫细胞出现桥甾醇的积累,使得泡沫细胞具有抗炎表型,而动脉粥样硬化病变中的巨噬细胞活化是由动脉壁内产生的外源性促炎信号引起的,这些信号抑制了桥甾醇的稳态和抗炎功能[13]。
高脂饮食的Ldlr/小鼠,除了减少最大线粒体呼吸外,高胆固醇血症还减少了脂多糖介导的磷酸戊糖途径(PPP)诱导和Nrf2介导的氧化应激反应,抑制PPP可减少脂多糖诱导的细胞因子分泌[14]。脂多糖即俗称内毒素,是革兰氏阴性细菌的细胞壁的成份,能引起发烧和炎症等症状。所以,高胆固醇和动脉粥样硬化的关系还有待科学确认。
在病理环境中,血管平滑肌细胞受病理性微环境的刺激,细胞行为改变为增殖、迁移、吞噬和炎症物质和胶原纤维分泌,在斑块形成的早期分泌炎症物质并形成泡沫样细胞,而在斑块的晚期稳定形成的斑块,参与推动了动脉粥样硬化斑块的形成和进展[15]。
2017年《新英格兰医学杂志》发表了以白细胞介素-1β固有免疫通路为靶点的卡那单抗进行抗炎治疗,与安慰剂相比,心血管事件复发率显著降低,与血脂水平降低无关[16]。这个临床研究成果进一步证明了炎症在动脉粥样硬化性心血管疾病(ASCVD)中的因果关系。因此,靶向炎症治疗被认为是治疗动脉粥样硬化的一种有前途的策略[17, 18]。
03
免疫系统参与血管的炎症
免疫反应参与动脉粥样硬化的每个阶段,深度参与了动脉粥样硬化的发生发展[19, 20]。免疫细胞的持续异常激活,导致炎症刺激的持续存在,同时伴随着累积的脂质沉积,最终导致内皮细胞功能障碍,甚至耗竭内皮祖细胞,是动脉粥样硬化的主要原因[21, 22]。
骨髓造血干细胞通过ABCA1和ABCG1转运载脂蛋白E(ApoE),ApoE能够促进动脉粥样硬化病变中HSPC增殖、单核细胞增多、中性粒细胞和单核细胞聚集,从而加剧了动脉粥样硬化的进展[23]。
因此,骨髓造血异常增强和先天免疫系统持续过度激活导致的慢性炎症性疾病(包括类风湿关节炎、肥胖、糖尿病和代谢综合征)也是动脉粥样硬化心血管疾病的主要危险因素,独立于传统的动脉粥样硬化心血管疾病危险因素[24, 25]。
比如,高胆固醇血症诱导的造血干细胞更倾向于分化为髓样细胞,尤其是粒细胞和高表达Ly6C的单核细胞,伴随着巨噬细胞产生的TNF-α增加17.0%,IL-6增加21.3%,MCP1增加10.5%,动脉粥样硬化斑块大小增加2.1倍[26]。

T淋巴细胞是调节动脉粥样硬化适应性免疫反应的主要细胞类型。研究表明,小鼠动脉粥样硬化斑块主要由CD4+T淋巴细胞组成,而人类动脉粥样硬化斑块既有CD4+也有CD8+T淋巴细胞。在动脉粥样硬化的发展过程中,长期高胆固醇血症损伤Treg细胞,导致Treg细胞数量减少,但不影响效应T细胞的积累,逆转高胆固醇血症可防止病变Treg的丢失[27]。
04
慢性感染炎症是一个重要病因
由慢性感染或代谢紊乱引起的亚临床内毒素血症是发生动脉粥样硬化等慢性炎症性疾病的一个重要风险因素[28, 29]。如果肠道粘膜有水肿等损伤,肠道中的脂多糖可经肠道吸收到血液循环中,导致低度内毒素血症,产生持续性低水平炎症,进而引发动脉粥样硬化,加剧斑块不稳定和血栓形成[29]。
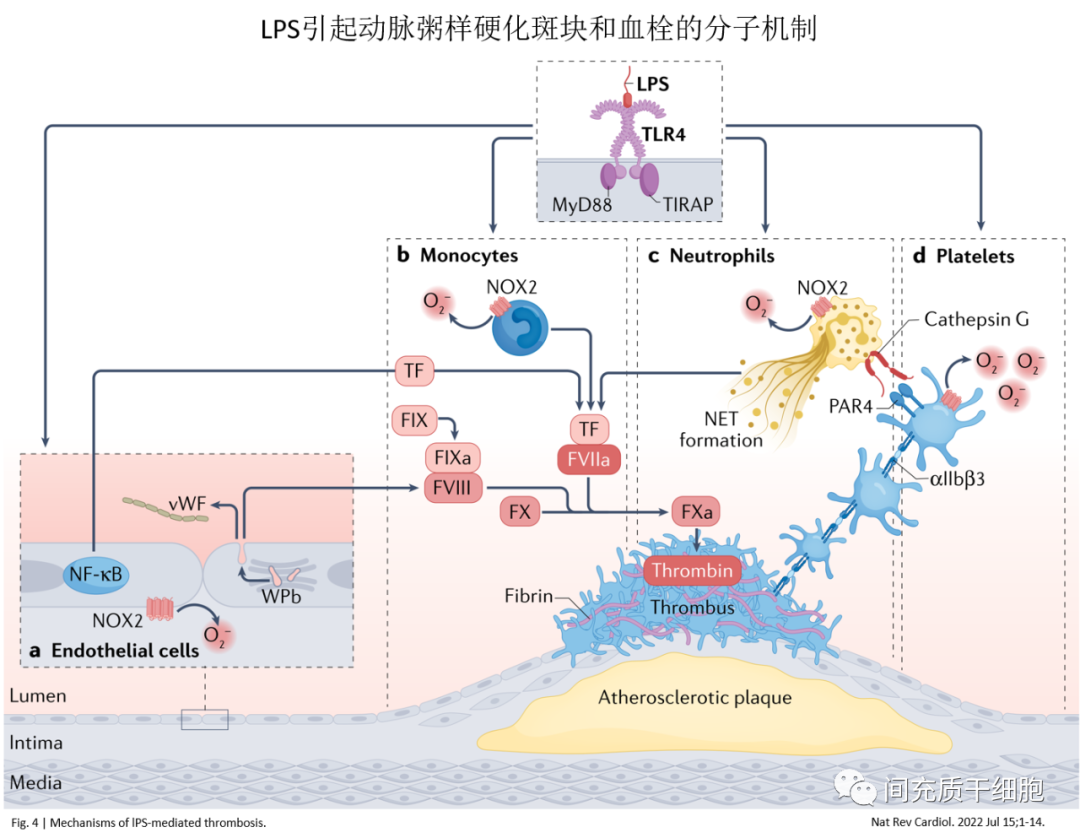
在动脉粥样硬化(ApoE)小鼠模型中,超低剂量脂多糖(lipopolysaccharides,LPS)短期应用以模拟慢性感染,引起单核细胞极化,进入持续的激活后促炎状态,Ly6C、CCR5、MCP-1上调,SR-B1表达水平降低,其结果是动脉粥样硬化加剧[30]。
05
动脉粥样硬化的传统治疗
预防动脉粥样硬化病变的发展或恶化(使用降血脂药物)仍然是主要的治疗策略,这显著改善了心血管疾病的预后。
一种可注射重组高密度脂蛋白(rHDL)纳米颗粒载体,可将他汀类药物输送至动脉粥样硬化斑块,个月低剂量他汀类rHDL治疗方案抑制斑块炎症进展,而1周高剂量方案显著降低晚期动脉粥样硬化斑块的炎症[31]。
06
动脉粥样硬化的MSC治疗
为何不推荐动脉粥样硬化患者的自体间充质干细胞(MSC)治疗?
首先,高龄、动脉粥样硬化和2型糖尿病降低了自身骨髓MSC的免疫抑制功能[32]。其次,从动脉粥样硬化患者中分离脂肪MSC,结果发现动脉粥样硬化患者脂肪MSC线粒体活性氧水平升高,伴随着糖酵解增强和细胞因子分泌改变,以及MSC的免疫抑制能力下降[33]。
MSC治疗动脉粥样硬化的原理
(1)平衡免疫系统,消除慢性炎症
由于免疫系统失调引起的慢性炎症性疾病,基于MSC的治疗可能对动脉粥样硬化的病理进展产生保护和治疗作用。
在动脉粥样硬化斑块的发病机制中,MSC增加了调节性T细胞(Tregs)与CD4+T细胞的比率,并促进巨噬细胞向M2表型分化,从而减少单核细胞浸润和炎症反应[34]。动脉粥样硬化小鼠经过MSC治疗后,循环单核细胞显著减少33%,血清CCL2水平显著降低77%,血清胆固醇降低了33%,促炎型巨噬细胞减少了56%,T细胞数量减少了61%,主动脉根部病变发展减少33%[35]。
MSC及其外泌体均能明显减少动脉粥样硬化小鼠体内血管炎性单核细胞/巨噬细胞的聚集,抑制巨噬细胞泡沫细胞的形成,减少炎性巨噬细胞的激活,降低血清中的炎性细胞因子(TNF-α和IL-6)水平,并减少斑块大小和脂质沉积[36-39]。因此,MSC消除炎症的特性有利于动脉粥样硬化的斑块稳定性[40]。
MSC改善动脉粥样硬化的根本原因有2点:①,MSC抑制异常激活的免疫细胞,促进调节性T细胞(Treg)的发育和增殖,从而减少免疫细胞对全身动脉血管的攻击和破坏;②,MSC通过诱导和刺激巨噬细胞转变为抗炎表型,从而消除慢性炎症。
(2)MSC促进内皮细胞的修复和增殖
氧化应激导致的线粒体生物能和生物发生受损是糖尿病患者内皮功能障碍的重要原因。MSC通过TNTs传送线粒体给低氧缺血区域的心肌细胞和内皮细胞,改善受体细胞的氧化应激状态和能量代谢,从而阻止心肌细胞和内皮细胞的凋亡[41, 42]。MSC通过向邻近的受伤细胞输送自身的线粒体,也是MSC发挥治疗作用的机制之一。这部分内容的详情请看《线粒体(能量供应器)能左右干细胞的命运吗?》(点击阅读)。
MSC通过Akt/eNOS通路提升eNOS水平和NO生成,逆转ox-LDL对内皮细胞的损伤,改善内皮细胞的功能,从而阻止动脉粥样硬化[43, 44]。MSC还可以通过激活Wnt信号通路,进而减少氧化应激对内皮细胞的损伤来减少内皮细胞凋亡[45]。
Sirt1是一种NAD+依赖性酶,巨噬细胞中的SIRT1使RelA/p65 NF-kB脱乙酰化来抑制Lox-1(oxLDL的清道夫受体)的表达,从而防止内皮衰老和炎症;Sirt1可调节肝脏X受体(LXR)的活性,从而促进斑块巨噬细胞中ABCA1驱动的胆固醇反向转运;Sirt1抑制内皮组织因子(凝血因子III)的表达,从而发挥抗血栓特性;因此Sirt1在动脉粥样硬化形成中起到保护作用[46]。MSC通过旁分泌作用上调内皮细胞的Sirt1的表达,再通过PI3K/Akt/Sirt1途径改善线粒体功能障碍,并通过Sirt1/AMPK/PGC-1α途径增强线粒体生物生成,从而发挥对内皮细胞的保护作用[47]。
MSC通过分泌PGE2来缓解系统性红斑狼疮(SLE)基础上的动脉粥样硬化,包括改善主动脉和肝脏动脉粥样硬化病变,并降低血清胆固醇、甘油三酯和低密度脂蛋白水平;同时MSC有效改善系统性红斑狼疮的病理,包括脾肿大、肾小球病变、血清中的抗双链DNA抗体、尿蛋白和血清肌酐[48]。
(3)MSC促进脂类代谢
MSC输注可以显著改善2型糖尿病小鼠的高血糖,降低肝转氨酶的升高,降低脂质含量,包括甘油三酯、总胆固醇和低密度脂蛋白胆固醇[49]。MSC抑制固醇调节元件结合转录因子1c(SREBP-1c)的表达,并提高肝脏中过氧化物酶体增殖物激活受体α(PPARα)和过氧化物酶增殖物激活物受体-辅激活物1(PGC-1α)的水平,促进低密度脂蛋白(LDL)和总胆固醇(TC)的下调和高密度脂蛋白的上调,并降低炎症因子TNF-α和IL-6水平[50]。

07
小结
最后需要强调的是,动脉粥样硬化的发生发展是一个缓慢的渐进过程,一旦确诊,就意味着已经出现了血管壁的实质性病变,因此,动脉粥样硬化的治疗是一个长期的、甚至是终身的事情,不能指望寥寥几次MSC治疗就能让硬化的血管变得软化和健康。健康饮食、健康的生活方式、适当的运动锻炼,依然是身体健康的基础性保障。动物实验的结果结合理论分析,MSC能改善动脉粥样硬化和促进血管的康复。
复制本文链接 文章为作者独立观点不代表本网站立场,未经允许不得转载。

 京公网安备
11010802036058号
京公网安备
11010802036058号
评论