导读
不少临床研究或临床试验的结果显示,间充质干细胞(MSC)能治疗多种疾病,尤其是一些疑难杂症,但是疗效各有差异。研究者开始冷静反思:具有治疗功能的间充质干细胞为何会临床疗效差异化较大?对于这个问题,不同的研究者有不同的思考和解释。
影响间充质干细胞(MSC)的疗效,有很多因素,本文主要讨论间充质干细胞(MSC)相关的关键影响因素:细胞质量、注射途径、最佳剂量、治疗时机。;其他影响因素还包括患者的疾病类型和医生的医疗技术和医院的整体实力水平等等.间充质干细胞(MSC)下文简称为MSC。
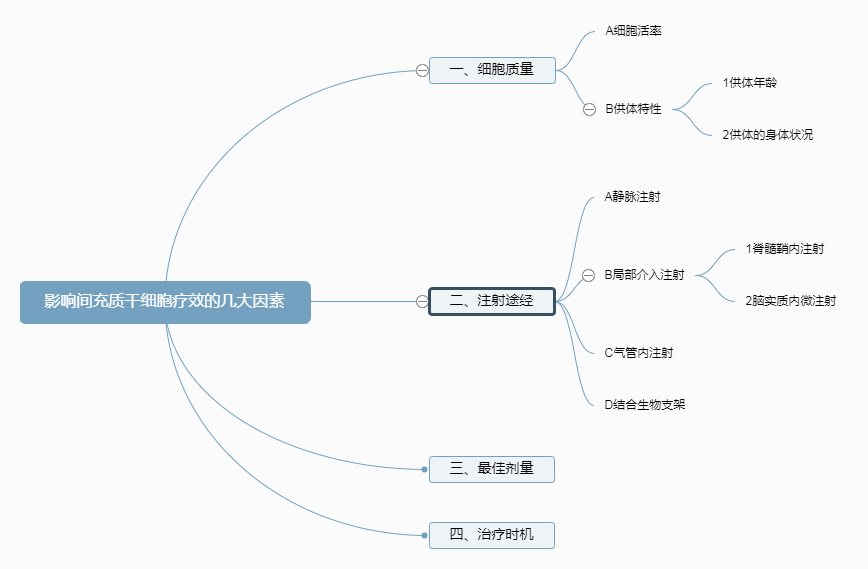
细胞质量
不同厂家生产出来的同一种药物,质量之间存在一些差异,尤其是进口药和国产药相比较,同样的情况也存在不同的干细胞公司。
大概定义一下 “细胞质量”指单位细胞或单个细胞所对应的生物学效力;效力越高,细胞质量越好。
有一些参数可以反映间充质干细胞的质量,比如细胞活率、供体特性、克隆形成能力、细胞大小、免疫抑制能力、和细胞因子分泌量。
1、细胞活率
是MSC进入人体之前,MSC针剂里还有多少MSC是活的?
不同的临床研究所用的细胞活率有所不同,细胞活率有>80%,有>85%,有88.2± 6.1%,有90%-97%,有>92%,有>95%,还有存在>70%的情况。
活率90%以上的细胞制剂和活率只有70%的细胞制剂,相同的疾病情况下,治疗效果难免会有较大的差异。MSC需要活着,而且还要扛过肺部的清除,才能很好地发挥治疗作用。
2、供体特性
供体特性包括 “供体年龄”和“供体的身体状况”。
(1)供体年龄
供体年龄是一个很重要因素,因为来自年轻供体的MSCs似乎具有更大的活力、增殖潜力和抗氧化能力,而年龄较大的成年来源的MSC具有较低的增殖能力。
从年龄上来讲,脐带、脐带血和胎盘应该最具优势,乳牙牙髓次之,而骨髓和脂肪就相对年龄大点了。
年龄越大,在骨髓中的干细胞就越少:刚出生时,骨髓1万个单个核细胞中就有1个是MSC;30岁时,MSC的数量减少到骨髓25万个单个核细胞中才有1个MSC;到80岁时,MSC的数量就更少了,骨髓200万个单个核细胞才有1个MSC。

性别可能对MSC的某些功能有影响。
比如有研究显示女性来源的MSC表达更高水平的IFN-γR1和IL-6β,从而具有更强的免疫抑制能力。
(2)供体的身体状况
有不少研究证明疾病也会影响自体间充质干细胞的功能,尤其是一些自身免疫性疾病患者,其自身骨髓的MSC出现功能异常,包括增殖速度减慢、克隆形成能力降低、免疫抑制能力下降、分泌生长因子的数量减少等等病理变化,使得患者自身骨髓MSC不适合用于自己疾病的治疗。
理论上,有可能存在某种先天性基因变异,导致MSC的功能出现缺陷,那么患者出生时的脐带、脐血和胎盘来源的MSC也不适合自体治疗。目前还没见到这样的文章报道,只是理论上存在这种可能性。
注射途径
1、静脉注射(全身性输入)
静脉注射是最常用和最简单的途径,并且允许输入大量的MSC。
静脉注射最大的弊端就是肺部能清除超过60%的MSC,造成趋化到损伤部位发挥治疗作用的MSC数量减少。肺血管系统的特性,允许直径小于5μm的微粒或细胞完全通过,而阻挡大部分直径超过20μm的微粒或细胞。人脐带来源的MSC细胞直径大部分集中在14-20μm的范围(见下图)。
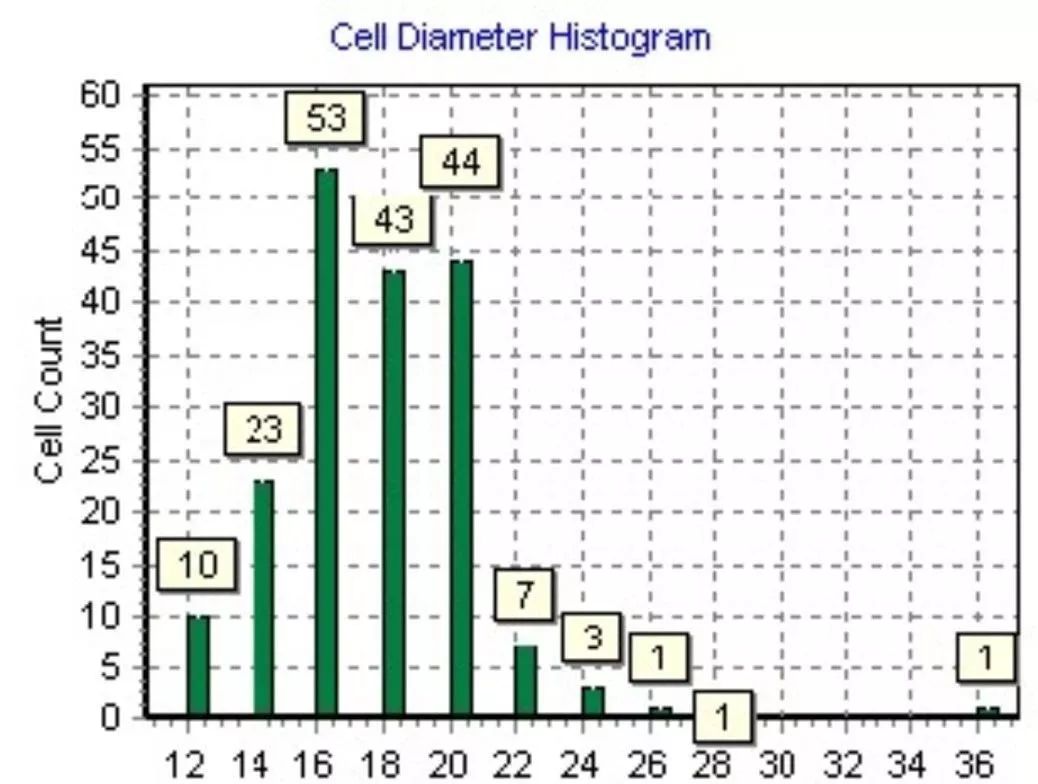
人脐血来源的MSC比人骨髓MSC容易通过肺脏,而且年龄越大的供体,其骨髓MSC越容易在小鼠肺部滞留;在肺部滞留的MSC细胞数量,与MSC细胞表面表达的整合素α4和α6密切相关,表达量越高,越不容易在小鼠肺部滞留。但是,如果MSC联合整合素抗体给患者使用,那么需要评估整合素抗体静脉注射所带来的风险。
在两项小型人体临床研究中,使用铟标记的MSC外周静脉输入患者体内,尽管早期在肺部发现了大部分信号,但48小时后大部分信号转移到脾脏和肝脏。MSC静脉输入体内10天后,至少尚有约50%的MSC存留在体内发挥作用,而肺部只有不到5%的滞留量(见下图)。
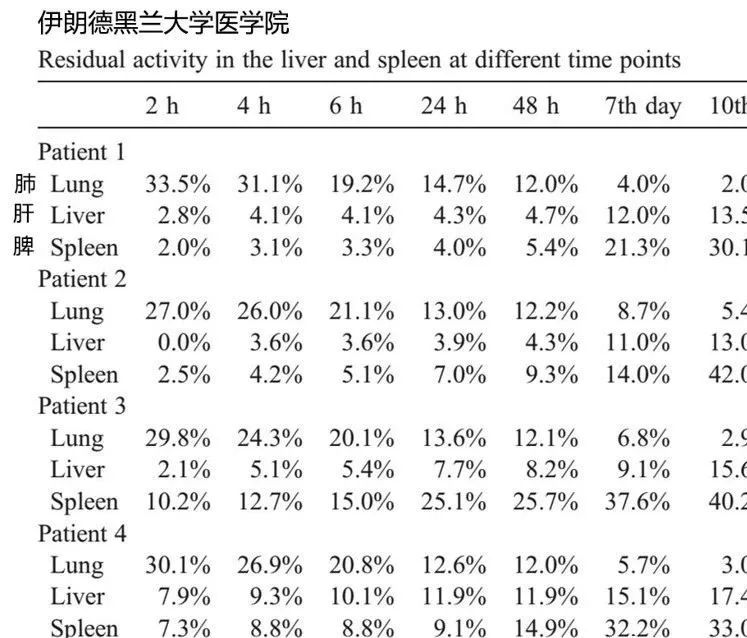
因此,我们不能单独依靠动物研究,需要结合临床研究来优化MSC的最佳治疗方案。
给大鼠静脉注射MSC后,96小时后给与检测,低氧环境增加MSC在肺部的滞留,而减少MSC在肝脏、脾脏和肾脏的数量(见下图)。

以此看来,患者使用MSC时,最好是提高肺部的血氧分压,至少是正常氧气含量的环境里。
2、局部介入注射
局部介入注射,包括联合生物材料的应用(例如用于矫形障碍的骨支架)、用于神经系统疾病的脊髓鞘内注射、用于呼吸系统疾病的气管内注射,都有利于MSC避开肺部的清除。
(1),脊髓鞘内注射
MSC应用的另一个常见输入途径是脊髓鞘内注射。
MSC的脊髓鞘内注射常见于治疗神经病变类疾病,包括中风、脑瘫、自闭症等,并且此技术亦可以应用于大多数儿童(包括早产儿)。
据报道,脐带来源的MSC鞘内注射到8对伴有脑瘫的双胞胎患儿,所有患者间隔3-5天接受4次鞘内注射,每次(1.0-1.5)×107个MSC,经治疗6个月后运动功能明显改善。另一临床研究显示异体MSC进行静脉和/或鞘内注射,可以提高脑瘫患儿的肌张力、力量、语言、记忆、认知能力等。
全身麻醉下鞘内注射MSC时,会出现与输注相关的不良反应,发烧和呕吐最常见,甚至出现比较严重的癫痫发作;但所有症状在72小时内自发消退,在6个月的随访期内没有出现进一步的并发症。有推测发烧和呕吐可能与全身麻醉有关。
(2),脑实质内微注射
在MSC治疗脑瘫的临床研究中,研究者评价了鞘内注射联合脑实质微注射MSC治疗脑瘫的可行性和有效性。在这个临床研究中,自体骨髓MSC在体外培养至4-5代,每次注射使用2X107的MSC剂量;所有患者均接受鞘内MSC,但年龄较大或头颅较大的患者(5岁或头围50 cm或更大),先接受2次鞘内注射,再进行立体定向手术接受了脑实质内MSC微注射治疗;所有患者的总运动功能评分均有不同程度的提高,但脑实质内微注射并未带来额外的益处。研究者只是观察到短暂的低温和伤口疼痛,但没有更严重的不良事件。
骨髓MSC在大脑缺血区域周边局部注射治疗中风(发病超过6个月)的临床研究,共18名患者,所有患者不开展康复治疗,经过1年的观察和评价(ESS、NIHSS、mRS和F-M总评分和运动功能评分),各种评分得到改善;但是,所有的患者都出现了不同程度的由于局部注射导致的副作用(经分析和MSC无关),包括头疼、恶心呕吐、抑郁、肌张力增高、疲劳、血糖升高、C反应蛋白升高。
(3),气管内注射
早产儿常伴随着支气管肺发育不良(BPD)的风险。一个小规模的临床实验验证MSC干预早产儿BPD的可行性。这9名平均妊娠25.3周的早产儿的平均体重为793克;前3名BPD患儿的MSC剂量为1X107/kg,后6名BPD患儿的MSC剂量为2X107/kg;治疗7天后,支气管分泌液中的炎症因子浓度明显下降,呼吸严重程度评分(Respiratory Severity Score)改善明显。
发生BPD风险的婴儿通常需要在出生时或出生后不久进行气管插管以进行机械通气和表面活性剂替代治疗,为MSC治疗提供了简便的输入途径。然而,目前的临床实践是在婴儿的医院疗程(通常是几天)中比在历史上(数周至数月)更早地移除气管导管。在这种情况下,MSC的静脉注射可能是气管内输入的可接受的替代方案,因为即使静脉输入MSC,MSC也可能被“捕获”在肺血管系统中。
(4),结合生物支架
干细胞结合生物支架治疗难治性疾病,尤其是神经损伤性疾病,是一个新的治疗手段。
有报道使用自体骨髓MSC联合脱矿骨基质支架,3个月后能实现约50%的骨缺损填充,不适合普遍临床应用。另外,也有研究显示在没有骨支架的情况下实现了79.1%的填充,但使用的MSC在体外经过成骨诱导的培养处理,表明细胞比其支持结构更重要。使用供体骨作为生长刺激因素可能有助于MSC用于颅骨重建。
南京鼓楼医院开展临床研究,MSC结合胶原支架进行子宫内移植,治疗子宫腔黏连,30个月后,26名患者中的10名成功受孕,8名孕妇顺利产下宝宝,1名孕妇怀孕3个月,1名孕妇出现自然流产。
最佳剂量
MSC的最佳剂量取决于不同的疾病和严重程度以及输入途径。
在MSC的临床研究和应用中,细胞剂量可能属于最无厘头的和最体现不出科学性的一个环节了,即使有一些临床研究涉及剂量爬坡实验,但也不是基于动物实验的基础。
由于MSC和传统药物的特性差异巨大,具体表现至少有2点。
①在MSC进入体内后,不符合传统药物典型的分布和代谢模型;传统药物属于被动分布,而MSC具有主动趋化到损伤部位的功能,MSC在健康机体和疾病机体的体内分布也不一样。
②传统药物的动物实验需要多次给药维持稳定的血药浓度,而MSC的动物实验常常是单次注射,以至于MSC的临床研究也常常采取1次注射的方案。实际上,MSC的单次注射并不能取得良好的稳定的长期的治疗效果,即使短期内有明显改善。
对于某种疾病,在临床前的研究中,动物实验并没有充分证明MSC起效的最低剂量和最大饱和剂量,而且不同实验室的细胞剂量存在差异。不同实验室的培养系统、MSC的来源属性等因素,常常导致MSC的质量存在差异,直接影响了MSC的动物实验和临床研究的结果(见下图)。因此,MSC的临床前研究的数据并不能很好地指导临床研究的方案确定。

在目前的临床研究中,MSC的使用剂量范围非常大,每名患者使用的MSC细胞数从四千多个MSC到上亿个MSC不等。
局部介入的治疗方式,最低的剂量出现在MSC治疗股骨头坏死的临床案例中,韩国和法国各一项临床研究用量为4500多个MSC。介入治疗最高的剂量出现在中国的一项临床研究,为MSC治疗糖尿病肢体大疱病,细胞用量为8.6亿;第二高剂量为2亿个MSC心肌注射。局部注射的MSC用量超过1亿的临床研究还有:1.2亿MSC治疗克隆氏病肠瘘、1亿MSC关节腔注射治疗膝骨关节炎的、1亿MSC治疗缺血性心肌病。
静脉输入的细胞剂量相对比较稳定,常常采用每公斤体重数百万级的MSC,即(1-10)x106/kg。静脉输入最高的剂量为与造血干细胞造血干细胞共移植的10x106/kg,按照60公斤的体重,那也是需要6亿个MSC了;还有治疗GVHD的8x106/kg[15,16]。静脉输入最低的剂量出现在MSC和造血干细胞共移植的临床实验中,为0.3x105/kg。虽然有专家认为5x106/kg和8x106/kg为高剂量,但是目前尚未对何种剂量定义为“高剂量”进行讨论和证明。
如果把MSC看作为“药品”,那么肯定存在一个范围,在这个范围内,剂量越高效果越好;然后达到一个饱和剂量后,继续提高细胞剂量,并不能带来更多的疗效,反而可能带来一些不良反应。
治疗时机
MSC输入的时间也很重要:MSC应该是预防还是治疗?
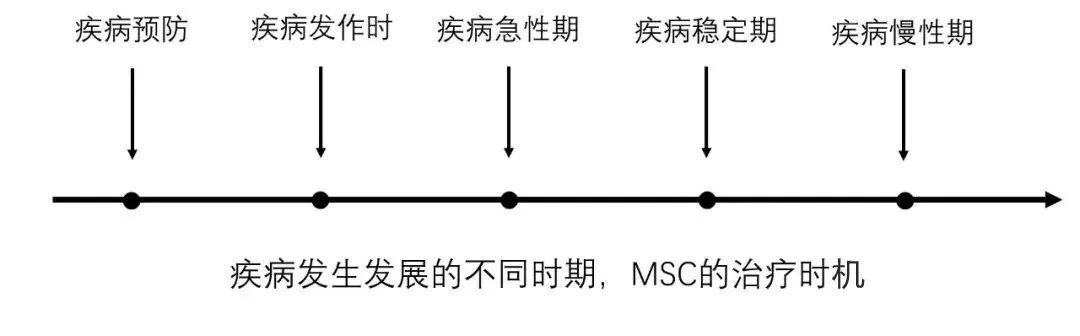
疑难重症的治疗中,MSC被寄予厚望;但这些疑难重症的疾病模型难于模拟临床实际情况。动物实验中,经常是刚刚注射完诱导疾病建立模型的药物后,就立即给与MSC治疗。比如MSC治疗急性肝衰竭的猪实验,在注射诱导疾病的药物2小时内给与MSC经肝门静脉介入治疗,效果非常显著;还有小鼠实验,用四氯化碳诱导急性肝衰竭,24小时内即刻给与MSC脾内注射治疗。
在临床研究中,也存在疾病尚未出现时给与MSC治疗的情况。MSC和造血干细胞共移植最为常见,MSC能减少造血干细胞移植后出现排异反应(GVHD)和增加造血干细胞移植的存活率,非常适合异体造血干细胞移植(骨髓移植)中配型达不到6个位点配对的情况。这时候,MSC起到辅助治疗的角色,为造血干细胞移植治疗保驾护航。
MSC促进糖尿病足的愈合,而且溃疡面的愈合并不伴随着疤痕组织的增生,这提示MSC能抑制疤痕组织增生,不仅适用于皮肤创伤的治疗(包括整形外科),还适用于开创性手术预防术后疤痕增生,比如最常见的腹腔术后肠粘连。需要注意的是,MSC的应用时机,因为MSC并不能消除疤痕组织,只是预防疤痕组织的出现。
细胞类药物和传统化学药物非常不同的一点,那就是细胞是活的,而化学药物是死的。MSC作为活的细胞,进入到机体,必定会与机体内的微环境相互作用。
在病理状态下,缺血缺氧微环境有利于MSC分泌更多的生长因子,而且炎症因子(TNF-α和IL-1β)能促进MSC分泌细胞因子(IL-1A、RANTES、G-CSF),但是总体来讲,炎症环境对MSC的影响是弊大于利。因为炎症因子同样能导致MSC死亡,炎症环境还能提高MSC的HLA-DR(MHC II类抗原)抗原的表达,增强了MSC的免疫原性,被免疫细胞所识别,加速了MSC的清除。
国内的一项MSC治疗肝衰竭的临床研究中发现,肝衰竭体内过激炎症反应的环境抑制了MSC的活性,限制其治疗肝衰竭的疗效;相反,较低的体内炎症环境有益于MSC定植、存活和肝细胞再生。国内的另一项MSC治疗类风湿性关节炎的临床研究,研究者先给患者注射剂鹿瓜多肽、丹参酮Ⅱa前期干预治疗7天,再给与MSC治疗;和单独的MSC治疗组相比,鹿瓜多肽和丹参酮Ⅱa前期干预后再联合MSC治疗,具有更显著的治疗效果,包括降低炎性细胞因子、调节免疫、改善微循环和病损组织的修复。
又比如,国外的多中心临床研究,在用骨髓MSC治疗类固醇无%E
复制本文链接 文章为作者独立观点不代表本网站立场,未经允许不得转载。

 京公网安备
11010802036058号
京公网安备
11010802036058号
评论